冰川水和五脉绿绒蒿提取物的美容功效研究
【类型】期刊
【作者】陈迪,章漳,蒋耀权,方兆华,丛峰松(上海交通大学生命科学技术学院;伽蓝(集团)股份有限公司)
【作者单位】上海交通大学生命科学技术学院;伽蓝(集团)股份有限公司
【刊名】日用化学工业
【关键词】 化妆品添加剂;冰川水;五脉绿绒蒿提取物;人真皮成纤维细胞;抗衰老;保湿
【ISSN号】1001-1803
【页码】P207-211
【年份】2019
【期号】第4期
【期刊卷】1;|7;|8;|4;|5;|2
【摘要】研究了冰川水和五脉绿绒蒿提取物对人真皮成纤维细胞(HDF-a)的作用。采用MTT法检测了冰川水和五脉绿绒蒿提取物对HDF-a增殖活性的影响,利用荧光试剂盒检测了二者对HDF-a内ATP水平的影响,利用酶联免疫吸附试验(ELISA)法检测了二者对HDF-a细胞外基质中透明质酸含量的影响,利用Western Blot法研究了二者对HDF-a细胞外基质中Ⅰ型胶原蛋白和弹性蛋白表达的影响。实验结果表明,与对照组相比,冰川水处理后HDF-a增殖速度加快、代谢水平提高、透明质酸含量上升、弹性蛋白表达上调,且差异有统计学意义。五脉绿绒蒿提取物对HDF-a的作用在上述方面更为明显,同时可以促进Ⅰ型胶原蛋白的表达。二者共同作用时效果更为显著。
【全文】 文献传递
冰川水和五脉绿绒蒿提取物的美容功效研究
摘要:研究了冰川水和五脉绿绒蒿提取物对人真皮成纤维细胞(HDF-a)的作用。采用MTT法检测了冰川水和五脉绿绒蒿提取物对HDF-a增殖活性的影响,利用荧光试剂盒检测了二者对HDF-a内ATP水平的影响,利用酶联免疫吸附试验(ELISA)法检测了二者对HDF-a细胞外基质中透明质酸含量的影响,利用Western Blot法研究了二者对HDF-a细胞外基质中Ⅰ型胶原蛋白和弹性蛋白表达的影响。实验结果表明,与对照组相比,冰川水处理后HDF-a增殖速度加快、代谢水平提高、透明质酸含量上升、弹性蛋白表达上调,且差异有统计学意义。五脉绿绒蒿提取物对HDF-a的作用在上述方面更为明显,同时可以促进Ⅰ型胶原蛋白的表达。二者共同作用时效果更为显著。
关键词:化妆品添加剂;冰川水;五脉绿绒蒿提取物;人真皮成纤维细胞;抗衰老;保湿
皮肤的衰老是一个长期复杂的生理及病理过程,既包括外界环境如紫外线、烟雾及一些化学物质等作用引发的外源性衰老[1,2],也包括由遗传基因调控和激素分泌变化[3]、机体代谢紊乱[4]等引起的自然衰老。皮肤衰老的临床特征主要表现为皮肤干燥萎缩、松弛下垂、色素沉积(老年斑形成)以及皱纹形成,在分子水平上则表现为皮肤细胞活力降低、增殖速率减缓、胶原合成能力减弱[5]以及细胞外基质主要成分降解[6]等。
植物来源的天然活性成分因其温和无刺激且兼具抗氧化、抗炎活性而被广泛应用于化妆品领域[7]。绿绒蒿是罂粟科(Papaveraceae)绿绒蒿属(Meconopsis Vig.)植物的统称,主要分布在喜马拉雅地区海拔3 000~5 500 m的高寒地带,具有很高的观赏性[8,9]。在中国西部藏族聚居地区,自古以来就有以该属多种植物入药的记载,当地俗称“刺儿恩”、“木琼”、“阿夏择哦”、“欧贝”、“红毛洋参”、“雪参”等[10-13]。《藏药志》中记载,五脉绿绒蒿(Meconopsis quintuplinervia Regel)是“欧贝”正品资源种类,具有清热解毒、利尿、消炎和止痛的药用功效[14]。近年来,多项研究[15,16]证明绿绒蒿中含有生物碱、黄酮和挥发油等化学成分,具有保肝、镇痛、抗氧化和抗炎等药理活性。但绿绒蒿提取物的美容功效至今尚无报道。低氘水的抗肿瘤、修复紫外损伤等生物学效应已被多篇文献[17-19]报道,冰川水作为一种罕见的天然低氘水,是地球上非常宝贵的优质水资源[20]。
基于此,笔者从分子水平上研究冰川水和五脉绿绒蒿提取物对人真皮成纤维细胞(HDF-a)的代谢水平、Ⅰ型胶原蛋白和弹性蛋白的表达以及透明质酸含量等方面的影响,以期为其在化妆品领域的应用提供科学依据。
1 实验部分
1.1 主要试剂与仪器
HDF-a,美国ScienCell公司;冰川水取自喜马拉雅山脉中段北坡海拔5 128 m的西藏日喀则岗巴县曲登尼玛泉;五脉绿绒蒿提取物(活性成分质量分数约为47%),伽蓝(集团)股份有限公司;DMEM培养基干粉、胰蛋白酶-EDTA溶液(w=0.05%),美国Gibco公司;胎牛血清,美国Corning公司;二甲基亚砜(DMSO)、磷酸盐缓冲液(PBS)、MTT细胞增殖及细胞毒性检测试剂盒,南京凯基生物科技发展有限公司;ATP检测试剂盒、BCA蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;透明质酸ELISA试剂盒,美国R&D Systems公司;兔抗人Ⅰ型胶原蛋白抗体、兔抗人弹性蛋白抗体,英国Abcam公司;驴抗兔荧光二抗,美国LI-COR公司。ENSPIRE 2300型全波长酶标仪,美国PE公司;Ti系列倒置显微镜,日本尼康公司;5810/5810 R型多功能台式离心机,德国Eppendorf 公司;ME203E型电子分析天平,梅特勒托利多公司。
1.2 实验方法
1.2.1 培养基配制
超纯水DMEM培养基:以超纯水配制含胎牛血清(φ=10%)的DMEM培养基;冰川水DMEM培养基:以冰川水配制含胎牛血清(φ=10%)的DMEM培养基;五脉绿绒蒿提取物的超纯水DMEM培养基:向超纯水DMEM培养基中加入五脉绿绒蒿提取物,使其所含活性成分质量分数为0.01%;五脉绿绒蒿提取物的冰川水DMEM培养基:向冰川水DMEM培养基中加入五脉绿绒蒿提取物,使其所含活性成分质量分数为0.01%。将4种培养基用0.22 μm滤膜过滤除菌,待后续实验使用。
1.2.2 细胞培养
将原代的HDF-a接种于超纯水DMEM培养基中,在37 ℃、CO2(φ=5%)、100%相对湿度的细胞培养箱中培养,2~3 d传代一次,选取4~6代状态良好的对数生长期细胞用于实验。
1.2.3 HDF-a增殖活性检测
采用MTT法检测HDF-a的增殖活性。参考文献[19]中的方法,取生长状态良好的对数生长期细胞,调整细胞浓度至1×105个/mL,混匀后接种于96孔板中,每孔100 μL,每组设6个复孔。待细胞完全贴壁后,以超纯水DMEM培养基培养的HDF-a作为对照组,分别以冰川水DMEM培养基、五脉绿绒蒿提取物的超纯水DMEM培养基、五脉绿绒蒿提取物的冰川水DMEM培养基培养的HDF-a作为冰川水组、提取物组和冰川水+提取物组,在CO2(φ=5%)、37 ℃下培养24 h。每孔加入50 μL MTT溶液,继续培养4 h,吸净MTT后每孔加入150 μL DMSO,振荡10 min后用全波长酶标仪测定波长490 nm处的吸光度。吸光度越高,表明细胞数量越多,增殖活性越强。
1.2.4 ATP水平检测
采用生物荧光试剂盒检测HDF-a内的ATP水平。取生长状态良好的对数生长期细胞按照1×105个/mL 的浓度接种于6孔板中。经4种不同培养基处理24 h后,按照试剂盒说明书进行操作,用全波长酶标仪检测样品荧光值,根据荧光均值及标准曲线计算出HDF-a内ATP水平。
1.2.5 透明质酸含量检测
将生长接近融合的细胞进行同步化处理——换用无血清DMEM培养基饥饿12 h,分别加入4种培养基继续培养24 h,收集细胞培养上清液备用。按照透明质酸ELISA试剂盒说明书进行操作,用全波长酶标仪测定波长450 nm处的吸光度,根据绘制的标准曲线计算HDF-a细胞外基质中透明质酸含量。
1.2.6 Ⅰ型胶原蛋白和弹性蛋白表达水平检测
按照BCA试剂盒说明书提取总蛋白并计算蛋白浓度,以对照组蛋白浓度为标准调整其他3组蛋白浓度。配制蛋白胶,各组取相同质量的蛋白样品约50 μg,进行SDS-PAGE电泳分离后,将蛋白转移至PVDF膜,用脱脂奶粉进行封闭,加入TBST稀释的不同的一抗,4 ℃孵育过夜,洗涤后加入HRP标记的二抗,室温孵育1 h,通过化学发光成像系统进行分析,比较2种目的蛋白与内参蛋白GAPDH条带吸光度的相对比值。
1.2.7 数据统计与分析
数据以“均值±标准差”表示。采用SPSS Statistics 19.0进行数据分析,多组间采取单因素方差分析,两两比较采用LSD和S-N-K法(方差齐性)以及Dunnett T3法(方差不齐)。P<0.05时认为差异有统计学意义。下文中*表示与对照组相比P<0.05;**表示与对照组相比P<0.01;#表示与冰川水组相比P<0.01;△表示与提取物组相比P<0.01。
2 结果与讨论
2.1 冰川水和五脉绿绒蒿提取物对HDF-a活性的影响
细胞活性主要体现在细胞的新陈代谢水平和细胞的增殖能力等方面[21]。活细胞线粒体中的琥珀酸脱氢酶能将黄色的MTT还原为不溶于水的蓝紫色甲臜并沉积在细胞中,可间接反映活细胞数量,即细胞增殖活性。ATP是活细胞最基本的能量来源,细胞死亡时,ATP迅速水解。因此,ATP的含量可及时反映细胞活性和活细胞数量[22]。实验通过检测冰川水和五脉绿绒蒿提取物处理后HDF-a的数量和细胞内ATP水平来探究其对人皮肤细胞活性的影响。
参考预实验结果,选取HDF-a增殖活力最高时五脉绿绒蒿提取物的处理浓度与处理时间进行本实验,即五脉绿绒蒿提取物的处理浓度和处理时间分别为0.01%和24 h(此时也是冰川水处理后HDF-a增殖活力最高的时间点)。不同处理方式对HDF-a增殖率的影响结果见图1。由图1可知,与对照组相比,用冰川水和五脉绿绒蒿提取物处理后HDF-a的增殖活性明显提高(P<0.05),且用五脉绿绒蒿提取物处理后HDF-a的增殖活性比冰川水显著;与五脉绿绒蒿提取物和冰川水单独作用相比,二者共同作用时促进HDF-a增殖的效果更加明显,差异具有统计学意义(P<0.01)。
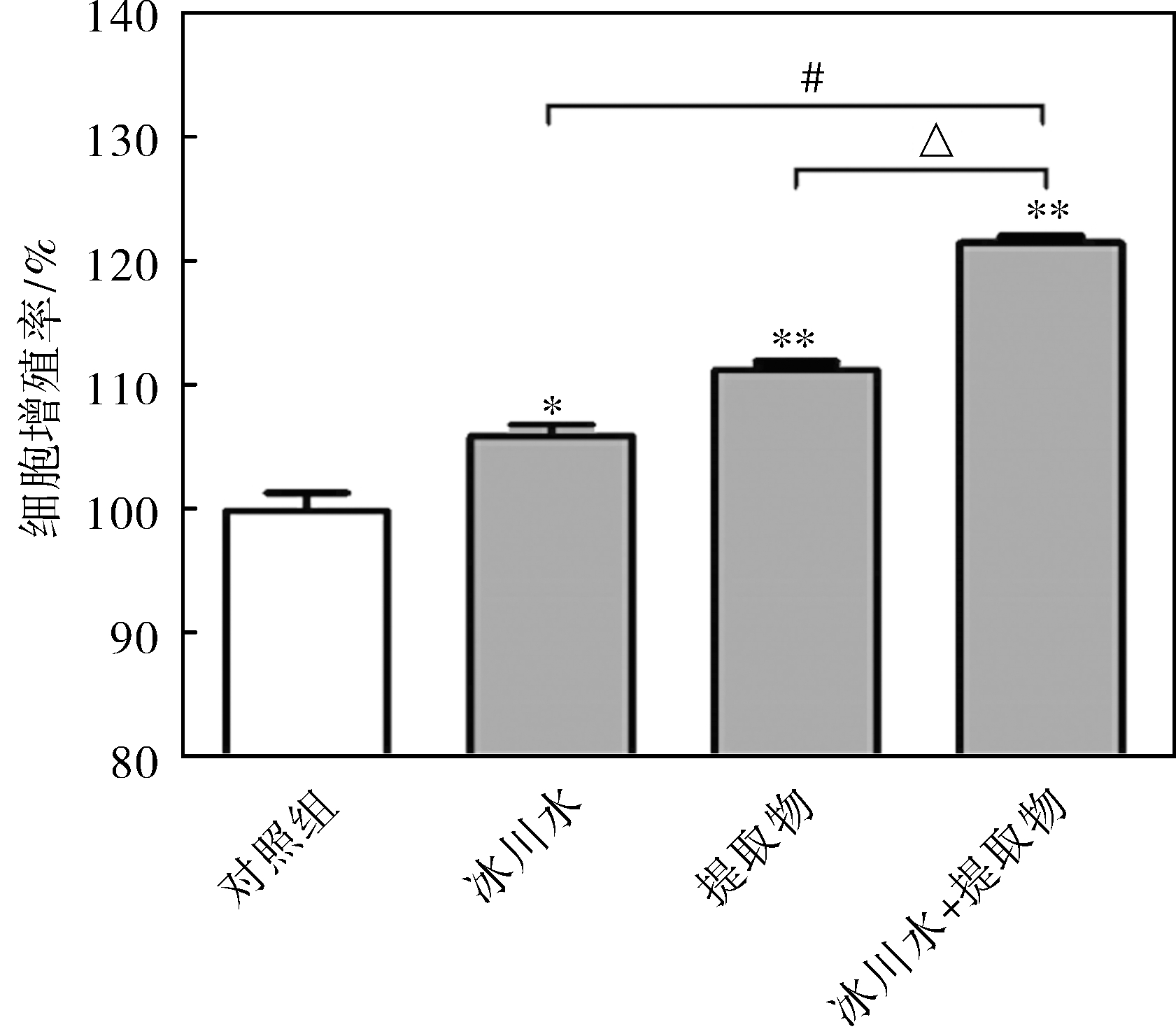
图1 处理方式对HDF-a增殖率的影响
Fig.1 Effects of different treatments on the proliferation of HDF-a
HDF-a内ATP水平检测结果如表1所示。由表1可以看出,与对照组相比,冰川水和五脉绿绒蒿提取物处理都显著提高了HDF-a内的ATP水平(P<0.01),且用2种方式处理后HDF-a内ATP水平间无显著差异;与五脉绿绒蒿提取物和冰川水单独作用相比,二者共同作用时HDF-a内ATP水平的提高更显著(P<0.01)。
表1 处理方式对HDF-a内ATP水平的影响
Tab.1 Effects of different treatments on the ATP level of HDF-a

处理方式对照组冰川水提取物冰川水+提取物c(ATP)/(nmol·L-1)58.74±4.66142.92±8.52**128.64±13.39**197.74±5.62**#△
成纤维细胞是真皮结缔组织中最主要的细胞,其细胞活力降低、增殖速率减缓是引发皮肤衰老的重要原因[5]。冰川水和五脉绿绒蒿提取物在促进HDF-a增殖、提高细胞活性上具有一定的效果,展现出其在促进皮肤新陈代谢、延缓衰老功能上的潜力。
2.2 冰川水和五脉绿绒蒿提取物对透明质酸含量的影响
透明质酸是细胞外基质中一类重要的非硫酸化黏多糖,在维持皮肤含水量、调节生理水平衡和渗透压等方面发挥重要功能,同时能够促进营养物质的运输和细胞代谢,是良好的吸收促进剂[7,23,24]。
ELISA法检测HDF-a细胞外基质中透明质酸含量结果见表2。由表2可知,与对照组相比,冰川水和五脉绿绒蒿提取物处理后透明质酸含量都有显著提高(P<0.01),且五脉绿绒蒿提取物的作用更明显;相比于冰川水和五脉绿绒蒿提取物单独处理,二者共同作用时对透明质酸含量的提高更显著。皮肤中透明质酸的含量随着年龄的增长逐渐流失[25],透明质酸含量的提高有利于维持皮肤的生理平衡,减缓衰老的速度。实验结果提示,冰川水和五脉绿绒蒿提取物可作为保湿、抗衰老成分添加至护肤品中。
表2 处理方式对HDF-a细胞外基质中透明质酸含量的影响
Tab.2 Effects of different treatments on content of hyaluronic acid in extracellular matrix of HDF-a

处理方式对照组冰川水提取物冰川水+提取物ρ(透明质酸)/(μg·L-1)26.43±0.3727.49±0.27**29.37±0.24**30.96±0.33**#△
2.3 冰川水和五脉绿绒蒿提取物对Ⅰ型胶原蛋白和弹性蛋白表达的影响
细胞外基质的降解是皮肤衰老的重要表现之一,胶原蛋白作为细胞外基质中最主要的结构蛋白,对于维持皮肤的机械强度起主要作用,其中Ⅰ型胶原蛋白占胶原蛋白总量的85%[26]。弹性纤维由弹性蛋白核心与周围富含原纤蛋白的微纤丝构成,虽然只占真皮干重的2%~4%,但是其形成的精密网状结构在保持皮肤弹性、防止变形方面发挥关键作用[24]。已有研究[27]表明,皮肤光老化过程中胶原蛋白与弹性蛋白含量的降低源于其合成速率的减缓、降解速率的加快,或者二者的共同作用。
实验用冰川水和五脉绿绒蒿提取物处理HDF-a后,采用Western Blot法检测Ⅰ型胶原蛋白和弹性蛋白的表达变化,Ⅰ型胶原蛋白和弹性蛋白电泳图见图2,表达分析图见图3。
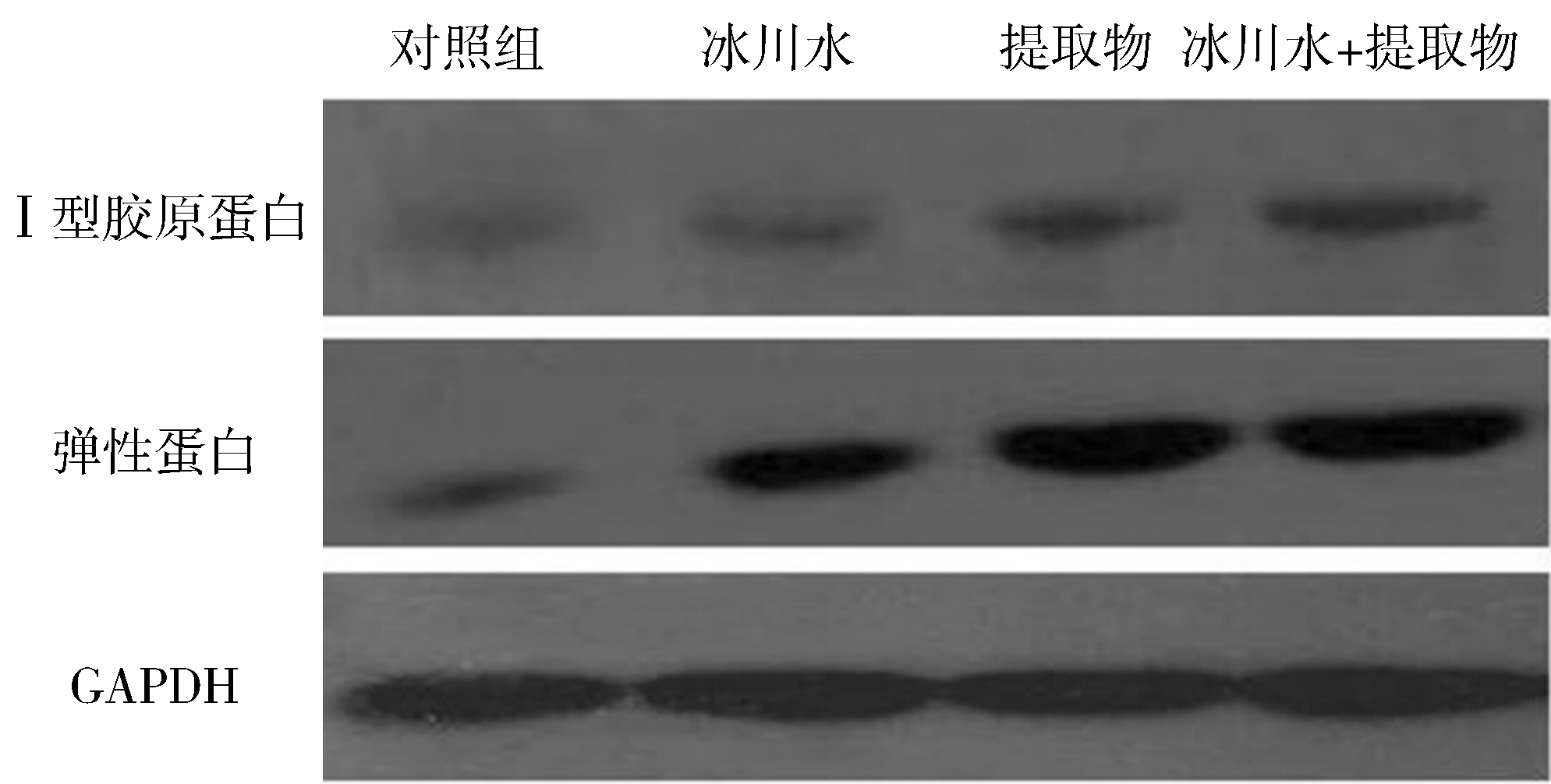
图2 处理方式对Ⅰ型胶原蛋白和弹性蛋白表达的影响(电泳图)
Fig.2 Effects of different treatments on expression of collagen I and elastin in HDF-a (electrophorogram)
由图2和3可知,经冰川水处理后,HDF-a细胞外基质中弹性蛋白表达显著上调,差异具有统计学意义(P<0.01),而Ⅰ型胶原蛋白的表达无明显变化;经五脉绿绒蒿提取物处理后,2种蛋白的表达均显著上调(P<0.01);相比于冰川水和五脉绿绒蒿提取物单独处理,二者共同作用对2种蛋白表达的促进作用更显著。推测冰川水和五脉绿绒蒿提取物可能通过促进细胞外基质中胶原蛋白和弹性蛋白的合成或抑制其降解来保持皮肤弹性,防止皮肤松弛与下垂。
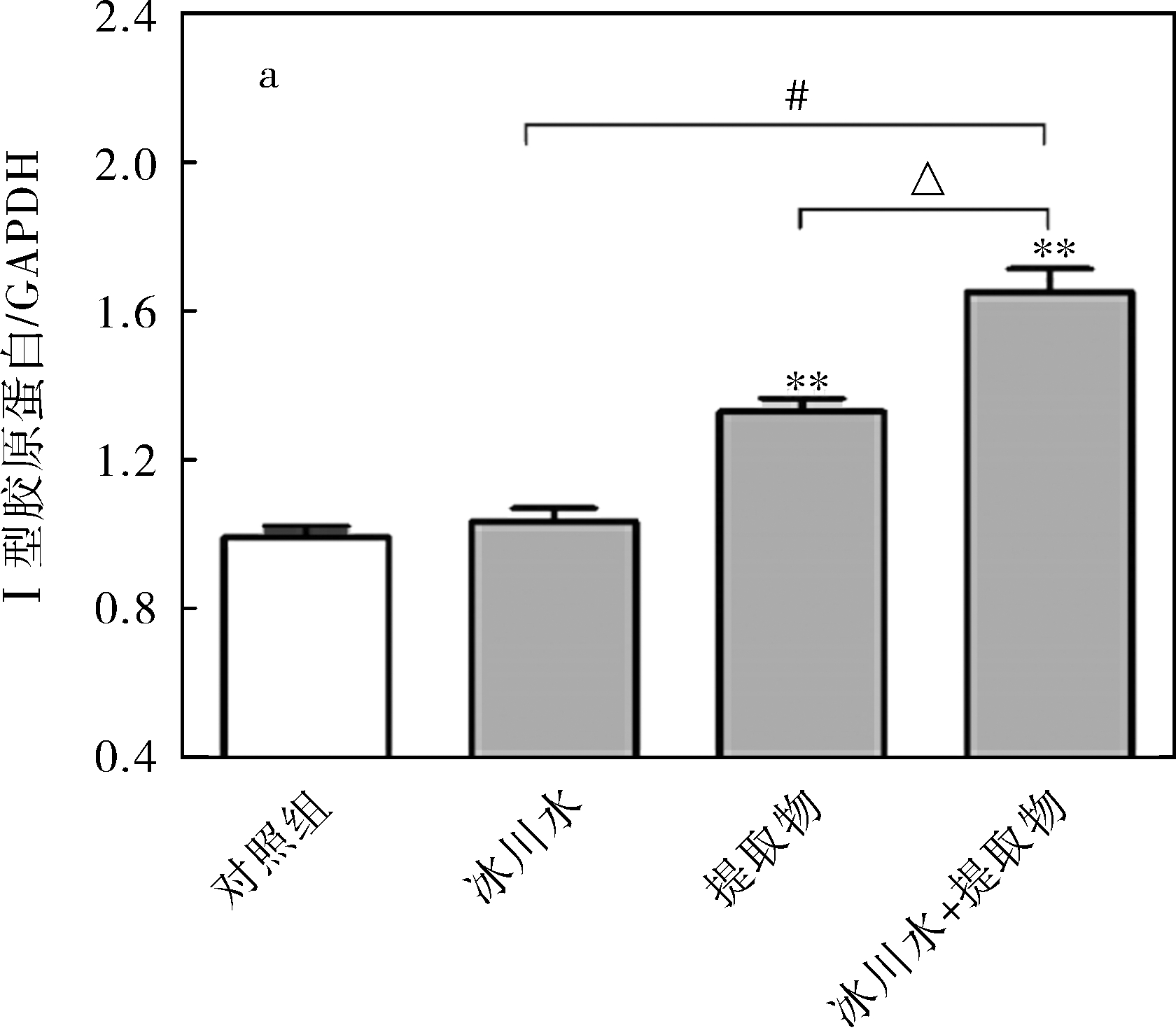
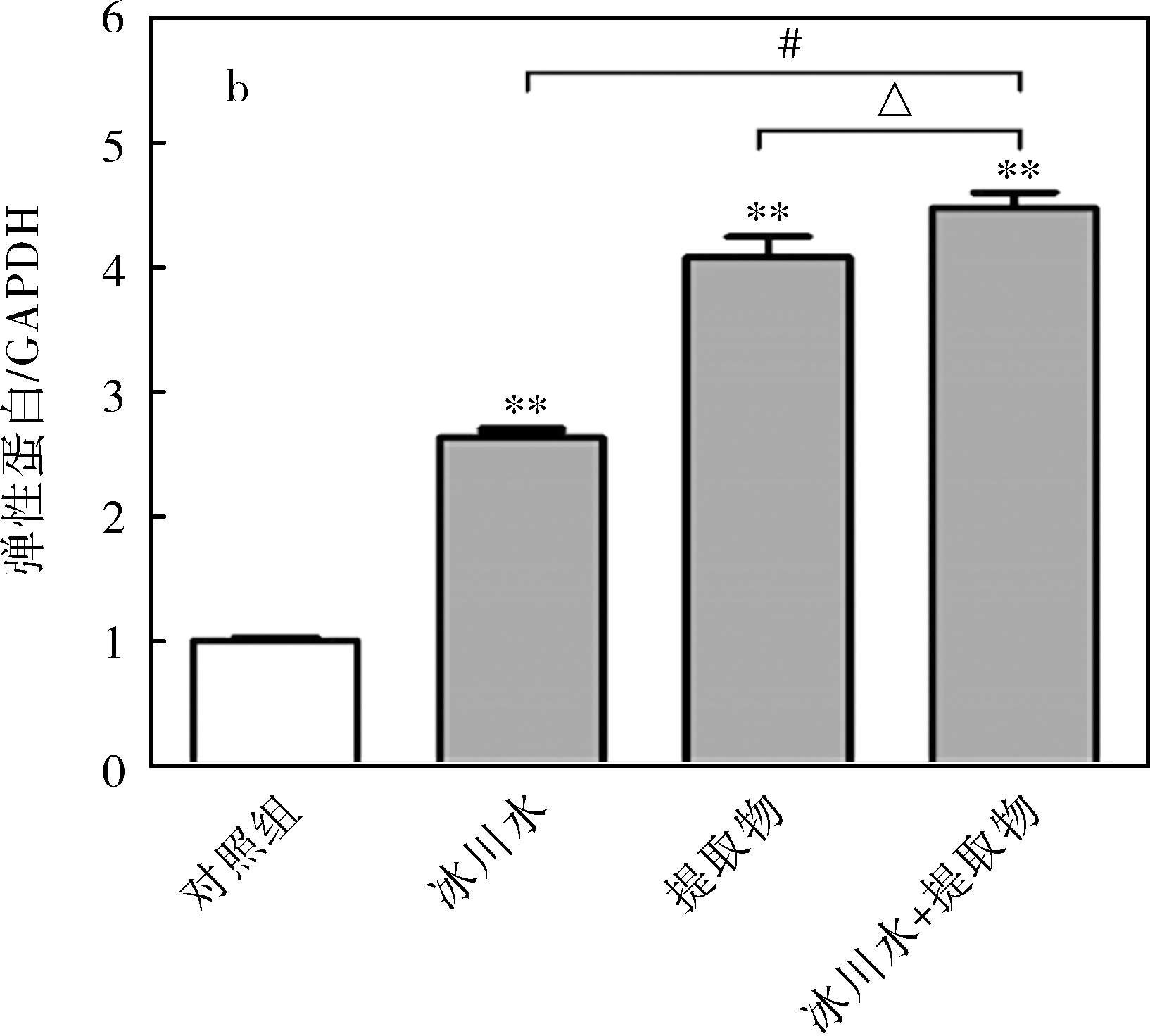
图3 处理方式对Ⅰ型胶原蛋白(a)和弹性蛋白(b)表达的影响(分析图)
Fig.3 Effects of different treatments on expression of collagen I (a) and elastin (b) in HDF-a (analysis diagram)
3 结论
冰川水能够提高HDF-a的增殖活性、代谢水平,提高HDF-a细胞外基质中透明质酸含量和Ⅰ型胶原蛋白、弹性蛋白等结构蛋白的表达水平。五脉绿绒蒿提取物的作用效果较冰川水明显。二者共同作用时效果更为显著。通过冰川水和五脉绿绒蒿提取物对人真皮层最主要的细胞HDF-a的影响可以预期:冰川水和五脉绿绒蒿提取物能够在一定程度上加强皮肤代谢、保持皮肤水嫩、增强皮肤弹性,具有一定的抗衰老和保湿等美容功效,可作为添加剂应用到护肤品中。
参考文献:
[1] Kammeyer A,Luiten R M.Oxidation events and skin aging [J].Ageing Research Reviews,2015,21:16-29.
[2] Yoshino A,Polouliakh N,Meguro A,et al.Chum salmon egg extracts induce upregulation of collagen type I and exert antioxidative effects on human dermal fibroblast cultures [J].Clinical Interventions in Aging,2016,11:1159-1168.
[3] Sator P G,Schmidt J B,Rabe T,et al.Skin aging and sex hormones in women-clinical perspectives for intervention by hormone replacement therapy [J].Experimental Dermatology,2004,13(S4):36-40.
[4] Kagan V E,Kisin E R,Kawai K,et al.Toward mechanism-based antioxidant interventions:lessons from natural antioxidants [J].Annals of the New York Academy of Sciences,2002,959:188-198.
[5] Hwang K A,Yi B R,Choi K C.Molecular mechanisms and in vivo mouse models of skin aging associated with dermal matrix alterations [J].Laboratory Animal Research,2011,27:1-8.
[6] Quan T,He T,Kang S,et al.Solar ultraviolet irradiation reduces collagen in photoaged human skin by blocking transforming growth factor-β type II receptor/smad signaling [J].The American Journal of Pathology,2004,165:741-751.
[7] Limtrakul P,Yodkeeree S,Thippraphan P,et al.Anti-aging and tyrosinase inhibition effects of Cassia fistula flower butanolic extract [J].BMC Complementary and Alternative Medicine,2016,16:497.
[8] 吴征镒,庄璇.绿绒蒿属分类系统的研究[J].云南植物研究,1980,2(4):371-381.
[9] 宋龙,张雯.绿绒蒿属藏药研究概况[C]//第一届全国中药商品学术大会论文集.北京:中国商品学会,2008.
[10] 中国科学院中国植物志编辑委员会.中国植物志[M].北京:科学出版社,1999.
[11] 冯志舟.绿绒蒿及其药用价值[J].云南林业,2004,25(5):24.
[12] 杜军华,张文静,李继荣,等.青藏高原特色植物资源绿绒蒿属植物的开发和利用[J].青海师范大学学报(自然科学版),2011(4):52-57.
[13] 帝玛尔·丹增彭措.晶珠本草[M].上海:上海科学技术出版社,1980.
[14] 杨永昌.藏药志[M].西宁:青海人民出版社,1991.
[15] 杨苗,史小波,闵康,等.绿绒蒿属植物化学成分及药理活性研究进展[J].中成药,2010(2):279-283.
[16] 吴海峰,丁立生,王环,等.绿绒蒿属植物化学成分及药理活性研究进展[J].天然产物研究与开发,2011(1):163-168.
[17] Soleyman-Jahi S,Zendehdel K,Akbarzadeh K,et al.In vitro assessment of antineoplastic effects of deuterium depleted water [J].Asian Pacific Journal of Cancer Prevention,2014,15:2179-2183.
[18] 丛峰松,张亚茹,王菊勇,等.低氘水对肺癌细胞增殖的抑制作用及其可能的机制[J].中国肿瘤生物治疗杂志,2009(5):48-49.
[19] 张亚茹,吴晟,姜银风,等.低氘水对皮肤成纤维细胞及黑色素瘤细胞的影响[J].天然产物研究与开发,2012(S1):96-100.
[20] 刘光琇,潘有福,陆卫.祁连山冰川水的生物学效应实验研究[J].冰川冻土,2004(6):784-787.
[21] Aina V H G,Stuart E J,Angus D M,et al.Purinergic receptor expression in the regenerating epidermis in a rat model of normal and delayed wound healing [J].Experimental Dermatology,2003,12:860-871.
[22] 李磊,杨雨晗,王双,等.细胞活性检测方法之比较[J].生物学杂志,2011(1):87-90.
[23] Stern R,Maibach H I.Hyaluronan in skin:aspects of aging and its pharmacologic modulation [J].Clinics in Dermatology,2008,26:106-122.
[24] Makrantonaki E,Zouboulis C C.Molecular mechanisms of skin aging:state of the art [J].Annals of the New York Academy of Sciences,2007,1119:40-50.
[25] Tammi R H,Tammi M I.Hyaluronan accumulation in wounded epidermis:a mediator of keratinocyte activation [J].The Journal of Investigative Dermatology,2009,129:1858-1860.
[26] Khavkin J,Ellis D A.Aging skin:histology,physiology,and pathology [J].Facial Plastic Surgery Clinics of North America,2011,19:229-234.
[27] Makrantonak E,Zouboulis C C.Characteristics and pathomechanisms of endogenously aged skin [J].Dermatology,2007,214:352-360.
(编辑:周 婷)
《日用化学工业》新版网络投稿系统正式运行
《日用化学工业》新版网络投稿系统(http://www.ryhxgy.cn)自2017年1月1日起正式运行,欢迎广大作者通过此系统向本刊在线投稿,自此本刊仅接受通过该投稿系统的稿件,不再接受其他形式的投稿,同时欢迎随时在线查询稿件处理进度和被录用情况。
热忱欢迎投稿!如有任何疑问,请随时与本刊编辑部联系。
电话:(0351)4062697,E-mail:gybjb@163.com或ryhxgy@163.com,QQ:1821773275。
《日用化学工业》编辑部
Study on cosmetological efficacy of glacier water and Meconopsis quintuplinervia extract
Abstract:The effect of glacier water andMeconopsis quintuplinervia extract on human dermal fibroblast-adult (HDF-a) was studied respectively and collaboratively.Effect of glacier water and Meconopsis quintuplinervia extract on cell proliferation activity of HDF-a was evaluated by MTT assay and on level of cellular ATP (adenosine triphosphate) with an ATP Assay Kit.Effect of glacier water and Meconopsis quintuplinervia extract on content of hyaluronic acid in extracellular matrix (ECM) of HDF-a was evaluated by Enzyme-linked immunosorbent assay (ELISA) and their effect on expression of collagenⅠand elastin in ECM was detected by Western Blot.The results show that,as comparing with the control group,glacier water can promote the proliferation activity and energy metabolism level of HDF-a as well as enhancing cellular content of hyaluronic acid compared with the control group.Glacier water also displays a capacity of enhancing the expression of elastin.All of the above-mentioned differences are statistically significant.The effect of Meconopsis quintuplinervia extract with respect to the above-mentioned aspects is more obvious than that of glacier water,and the extract shows an ability of promoting the expression of collagenⅠ.When glacier water and Meconopsis quintuplinervia extract are used collaboratively,their efficacy on HDF-a is much more obvious.
Key words:cosmetic additive;glacier water;Meconopsis quintuplinervia extract;HDF-a;anti-sanility;moisturizing
收稿日期:2016-11-26;
修回日期:2017-03-31
中图分类号:TQ658
文献标识码:A
文章编号:1001-1803(2017)04-0207-05
DOI:10.13218/j.cnki.csdc.2017.04.006
