冰川前缘土壤微生物原生演替的生态特征——以乌鲁木齐河源1号冰川为例
【类型】期刊
【作者】王晓霞,张涛,孙建,张雪兵,李忠勤,娄恺(新疆大学生命科学与技术学院;新疆农业科学院微生物应用研究所;新疆农业大学食品科学学院;中国科学院寒区旱区环境与工程研究所冰冻圈科学国家重点实验室)
【作者单位】新疆大学生命科学与技术学院;新疆农业科学院微生物应用研究所;新疆农业大学食品科学学院;中国科学院寒区旱区环境与工程研究所冰冻圈科学国家重点实验室
【刊名】生态学报
【关键词】 冰川前缘;原生演替;1号冰川;生态特征
【资助项】国家973计划前期研究专项(2008CB417214);新疆特殊环境微生物实验室开放课题(XJYS0203-2008-04)
【ISSN号】1000-0933
【页码】P6563-6570
【年份】2019
【期号】第23期
【期刊卷】1;|7;|8;|4;|5;|2
【摘要】为了解冰川前缘土壤微生物在原生演替过程中的生态特征及其影响因素,用空间距离代替时间序列,以乌鲁木齐河源1号冰川终碛堤为起点,沿6个不同演替时期(0,4,15,31,43a和对照)的样带采集土样,以冰川附近发育良好的土壤为对照,测定土壤酶活性、微生物氮矿化与脱氨作用以及微生物生物量。结果表明,土壤脲酶、蛋白酶、酸性磷酸酶、芳基硫酸酯酶、蔗糖酶活性、微生物氮矿化及脱氨作用随演替时间而增加,微生物生物量碳和氮变化呈波动状,趋势不明显。相关分析表明,土壤有机质与酶活、微生物生物量存在极显著正相关(P<0.01)。1号冰川前缘微生物多样性指数随着演替时间持续增加,但目前仍未达稳定状态。
【全文】 文献传递
冰川前缘土壤微生物原生演替的生态特征
——以乌鲁木齐河源1号冰川为例
摘要:为了解冰川前缘土壤微生物在原生演替过程中的生态特征及其影响因素,用空间距离代替时间序列,以乌鲁木齐河源1号冰川终碛堤为起点,沿6个不同演替时期(0,4,15,31,43a和对照)的样带采集土样,以冰川附近发育良好的土壤为对照,测定土壤酶活性、微生物氮矿化与脱氨作用以及微生物生物量。结果表明,土壤脲酶、蛋白酶、酸性磷酸酶、芳基硫酸酯酶、蔗糖酶活性、微生物氮矿化及脱氨作用随演替时间而增加,微生物生物量碳和氮变化呈波动状,趋势不明显。相关分析表明,土壤有机质与酶活、微生物生物量存在极显著正相关(P<0.01)。1号冰川前缘微生物多样性指数随着演替时间持续增加,但目前仍未达稳定状态。
关键词:冰川前缘;原生演替;1号冰川;生态特征
自“小冰期”后[1],全球气温持续性变暖。冰川作为气候变化最敏感的区域之一,在全球范围内发生了大面积退缩,形成了称为冰川前缘的原生裸地,它们代表了土壤物理、化学和生物梯度的时间序列[2]。原生演替指开始于原生裸地或原生芜原(完全没有植被并且也没有任何植物繁殖体存在的裸露地段)的群落演替[3]。因此可用冰川末端退缩距离代表演替时间,沿着空间梯度研究生物群落演替的过程[4],冰川前缘是研究原生演替的天然实验室。
通常,冰川前缘生物原生演替的一般模式为微生物→藻类→地衣→苔藓→高山草甸→亚高山草甸[5]。虽然微生物在原生演替过程中发挥了重要的生态学功能,如,作为先锋生物推动原始土壤的发育和形成,参与生物地球化学循环,为后续生物的定居和生长提供物质基础,但是有关冰川前缘微生物原生演替的生态特征知之甚少[6]。
现有研究主要集中在利用非培养方法揭示冰川前缘微生物物种多样性。Graeme等人[7]采用变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE),发现奥地利Rotmoosferner冰川前缘土壤古菌在大约150a的演替过程中,早期优势种群为非嗜热泉古菌(Crenarchaeota),中期为常温泉古菌;Deiglmary等人[8]提取阿尔卑斯中部冰川前缘早熟禾的根际土壤总DNA,对其中的硝酸盐还原酶基因进行限制性片段长度多态性 (restriction fragment length polymorphism,RFLP)分析,发现硝酸盐还原细菌的多样性在演替中、后期逐渐降低。虽然利用分子生物学手段评价微生物群落结构很有效,但却难以反映其活性及功能。
土壤酶主要来源于微生物、土壤动物、植物根系以及植物残体[9]。但是土壤中的酶很大一部分是由土壤中的微生物分泌的,所以土壤酶活性经常作为土壤微生物生长和活性的指标[10]。有研究表明,土壤酶活性与土壤微生物参数之间有一定的相关性[11]。土壤酶活能直接反映土壤微生物群落的代谢需求和营养供给[12],微生物生物量的大小可以间接表征具有调控土壤质量及有机物质转化功能的种群数量[13-14],采用这些指标,Tscherko等人[15] 发现,在阿尔卑斯中部冰川前缘土壤微生物的原生演替过程中,其酶活性的Shannon多样性指数持续增长,于演替中期(50a)达到稳定状态。乌鲁木齐河源1号冰川地处亚洲中心,作为亚洲干旱及半干旱区冰川的代表,其冰川前缘微生物生态特征是否遵循相似变化规律,国内外未有报道。为此,本研究拟通过测定土壤酶活(脲酶,蛋白酶,磷酸酶,芳基硫酸酯酶,蔗糖酶)、微生物生物量(微生物生物量碳和氮)以及微生物氮矿化与脱氨作用,具体回答这一科学问题。
1 材料与方法
1.1 研究区概况
乌鲁木齐河源1号冰川(86°49′E,43°06′N )位于天山东段,距乌鲁木齐市区约120km,为世界冰川监测服务处(WGMS)选定的全球十条代表性冰川之一,是亚洲干旱及半干旱区冰川的代表,中国科学院天山冰川观测试验站长期对之观测。该地区年平均气温5.2℃,负温月长达7—8个月,最冷月(1月份)平均气温-15.6℃,最热月(7月份)为4.9℃,年平均降水量441.1mm[16]。自1959年有观测记录以来,1号冰川一直处于退缩状态,东、西两支冰舌在1993年完全分离,成为独立的两支冰川[17]。周围分布着大量冰碛沉积物,不稳定矿物以普通角闪石为主,较稳定矿物以绿帘石为主;轻矿物主要为石英,碱性长石和斜长石等[18]。
1.2 土壤样品的采集
2008年8月,以1号冰川东支终碛堤为起点,建立了5个与其平行的样带,分别距离冰川0、18、60、120、180m。采集距冰川外约500m处发育良好的土壤作为对照。0m样带几乎是裸露的地面,无植被覆盖,18m至180m样带均有植物分布,但植物种类稀少,主要植物为高山早熟禾(Poa alpina)和小甘菊(Canerinia discaiden),但只占地表面积的1%—2%,对照为高山或亚高山草甸。在各样带上每隔15—20m处表面0—10cm非植物根际土样3份,装入无菌塑料袋。4℃运回实验室并保存。去除石块,风干、研磨、过筛后的土样用于土壤酶活、微生物作用和土壤化学性质的测定,微生物生物量的测定采用新鲜土样。
根据中国科学院天山冰川观测试验站多年观测的冰川退缩数据,定0m样带为0a,距离冰川越远,演替时间越长,推断各样带的演替时间。0m到180m样带对应的时间分别为:0,4,15,31,43a。
1.3 试验方法
1.3.1 土壤部分化学性质分析
按照土壤分析方法标准(DB/6500 B11)测定1号冰川前缘土壤化学性质。pH采用玻璃电极法;有机质测定用重铬酸钾氧化法;有效氮采用碱解法测定;有效磷采用碳酸氢钠浸提-钼锑抗比色法测定;有效钾测定采用醋酸铵-火焰光度法。总磷采用高氯酸-硫酸酸溶法测定,总盐采用烘干法。
1.3.2 土壤酶活的测定
脲酶活性用苯酚-次氯酸钠比色法测定[19],蛋白酶的活性用改良的茚三酮比色法[20],芳基硫酸酯酶的活性用Tabatabai的方法[21]测定,酸性磷酸酶的测定是采用对硝基苯磷酸盐法[22]。蔗糖酶的活性用3,5-二硝基水杨酸法[19]测定。
1.3.3 微生物氮矿化及脱氨作用的测定
脱氨作用通过测定精氨酸脱氨酶活性来确定[23]。氮的矿化作用淹水培养法[24]测定。
1.3.4 微生物量碳和氮的测定
微生物生物量碳用氯仿熏蒸浸提法测定[25],氯仿熏蒸和未熏蒸土壤用0.5mol/L K2SO4 溶液浸提,浸提液中有机碳含量采用TOC-VCPH总有机碳自动分析仪(日本岛津)测定。微生物量氮参照Brookes等人[26]的方法测定。
1.3.5 酶活性的多样性分析
酶活的多样性指数[15]由Shannon多样性指数确定:
式中,pi为第i种酶活与对照酶活的比值;K为试验中测定的酶的种类;Shannon’s 均匀度 EH,EH=H/lnS,S为各样带检测的酶总数。
1.3.6 数据统计分析
用Excel2003和SPSS16.0软件进行方差分析和多重比较。土壤化学性质与酶活和生物量的关系用复相关分析;以有机质作为控制变量对酶活和生物量的影响进行偏相关分析。根据各演替时间的酶活性和微生物氮矿化及脱氨作用的变化,应用层次聚类的方法进行分析。
2 结果
2.1 土壤化学性质随演替时间的变化
对照土壤的有机质、有效磷、有效钾和有效氮含量均高于其余演替时间(表1),pH值低于演替阶段的土壤。随着演替进行,土壤有机质含量从8.03 g /kg增加到75.59g/kg,在演替31a最小(4.75g/kg),总盐含量在0.34mg/g至2.05mg/g之间波动,总磷含量在演替43a时达到最大(1.08 mg/g)。
表1 不同演替时间土壤的部分化学性质
Table 1 Some chemical properties in soils of varying ages along the chronosequence
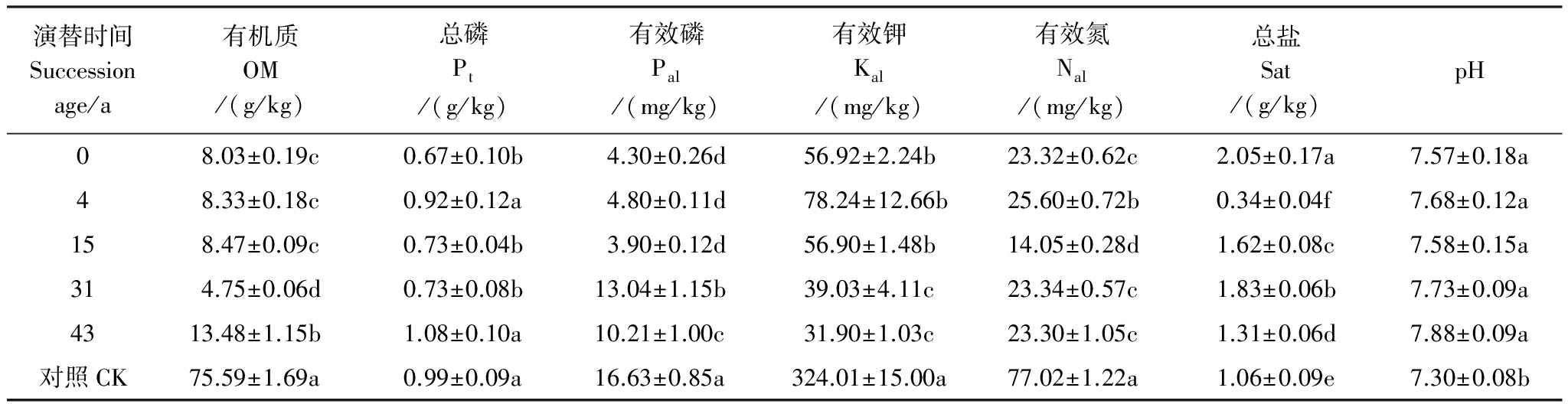
演替时间Successionage/a有机质OM/(g/kg)总磷Pt/(g/kg)有效磷Pal/(mg/kg)有效钾Kal/(mg/kg)有效氮Nal/(mg/kg)总盐Sat/(g/kg)pH08.03±0.19c0.67±0.10b4.30±0.26d56.92±2.24b23.32±0.62c2.05±0.17a7.57±0.18a48.33±0.18c0.92±0.12a4.80±0.11d78.24±12.66b25.60±0.72b0.34±0.04f7.68±0.12a158.47±0.09c0.73±0.04b3.90±0.12d56.90±1.48b14.05±0.28d1.62±0.08c7.58±0.15a314.75±0.06d0.73±0.08b13.04±1.15b39.03±4.11c23.34±0.57c1.83±0.06b7.73±0.09a4313.48±1.15b1.08±0.10a10.21±1.00c31.90±1.03c23.30±1.05c1.31±0.06d7.88±0.09a对照CK75.59±1.69a0.99±0.09a16.63±0.85a324.01±15.00a77.02±1.22a1.06±0.09e7.30±0.08b
OM:organic matter;Pt:total phosphorus ;Pal:available phosphorous ;Kal:available potassium;Nal:available nitrogen ;Sat:total salt;
同列不同小写字母表示0.05水平下差异显著
2.2 土壤酶活随演替时间的变化
土壤酶(脲酶,蛋白酶,蔗糖酶,芳基硫酸酯酶和磷酸酶)活性随演替时间的变化规律不完全一致,对照土壤酶活高于其余各演替时间(图1)。脲酶、蛋白酶和蔗糖酶(图1a,b,d)在演替0a至43a间具有相同的趋势,即0a最小,4a增加,15a降低,再逐渐增加;芳基硫酸酯酶和磷酸酶活性(图1e和f)随演替时间的变化相同,从0a增加至15a,31a降低,然后增加;与其它酶相比,0a的脲酶和蔗糖酶活性最低,分别只占对照土壤的0.34%和1.85%。
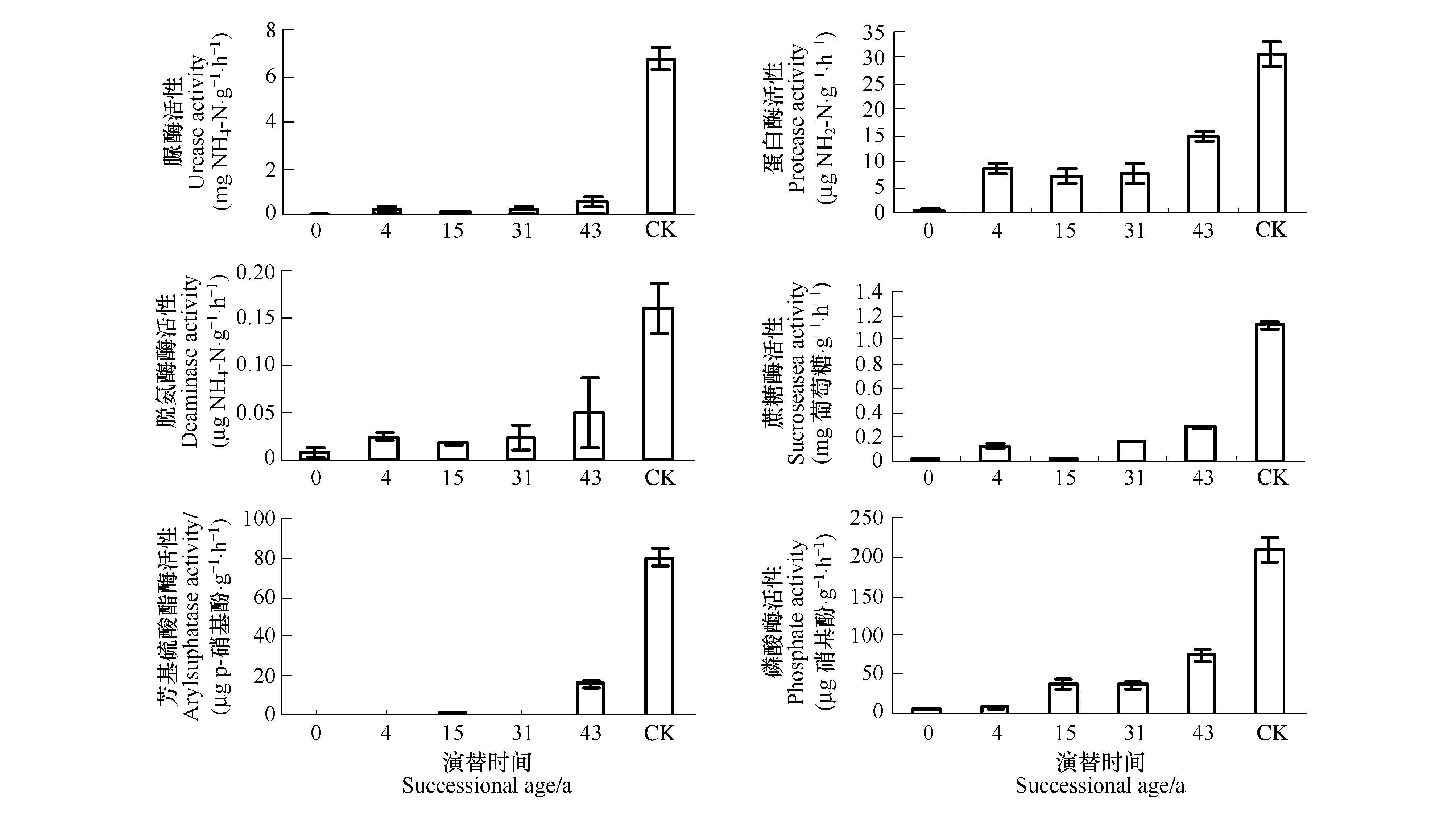
图1 1号冰川前缘各演替时间土壤酶活(脲酶、蛋白酶、脱氨酶、蔗糖酶、芳基硫酸酯酶和磷酸酶)
Fig.1 Microbial enzymes activities (Urease,Sucrosease,Protease,Deaminase,Arylsuphatase and Phosphate)in soils of varying ages along the chronosequence
2.3 土壤微生物生物量和微生物氮矿化及脱氨作用随演替时间的变化
微生物生物量碳随时间序列先降低后升高(表2),而微生物生物量氮变化趋势不明显,对照土壤的微生物量碳、氮高于其余各演替时间。土壤的微生物氮矿化及脱氨作用变化具有相同的规律(图1和表2),并且与脲酶、蛋白酶及蔗糖酶变化趋势相似(图1)。氮矿化速率在演替43a时就达到了对照的一半以上(表2),而脱氨酶活性在43年只有对照的36.7%(图1),微生物量碳氮比(表2)呈现出先降低后增加的状态。
表2 各演替时间土壤的微生物量碳、氮,氮矿化和微生物量碳氮比(Cmic / Nmic)
Table 2 Microbial biomass carbon and nitrogen,N mineralization,C/N ratio of microbial biomass of soils along the chronosequence
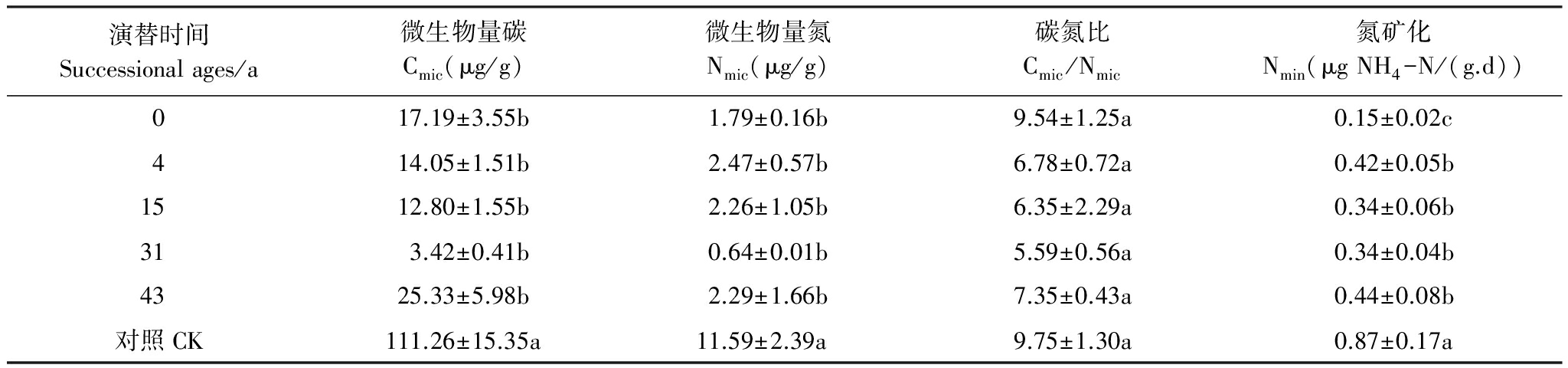
演替时间Successionalages/a微生物量碳Cmic(μg/g)微生物量氮Nmic(μg/g)碳氮比Cmic/Nmic氮矿化Nmin(μgNH4-N/(g.d))017.19±3.55b1.79±0.16b9.54±1.25a0.15±0.02c414.05±1.51b2.47±0.57b6.78±0.72a0.42±0.05b1512.80±1.55b2.26±1.05b6.35±2.29a0.34±0.06b313.42±0.41b0.64±0.01b5.59±0.56a0.34±0.04b4325.33±5.98b2.29±1.66b7.35±0.43a0.44±0.08b对照CK111.26±15.35a11.59±2.39a9.75±1.30a0.87±0.17a
Cmic:microbial biomass carbon;Nmic:microbial biomass nitrogen;Nmin:mineralization of nitrogen
注:同列不同小写字母表示0.05水平下差异显著
2.4 不同演替阶段微生物生态特征的聚类分析
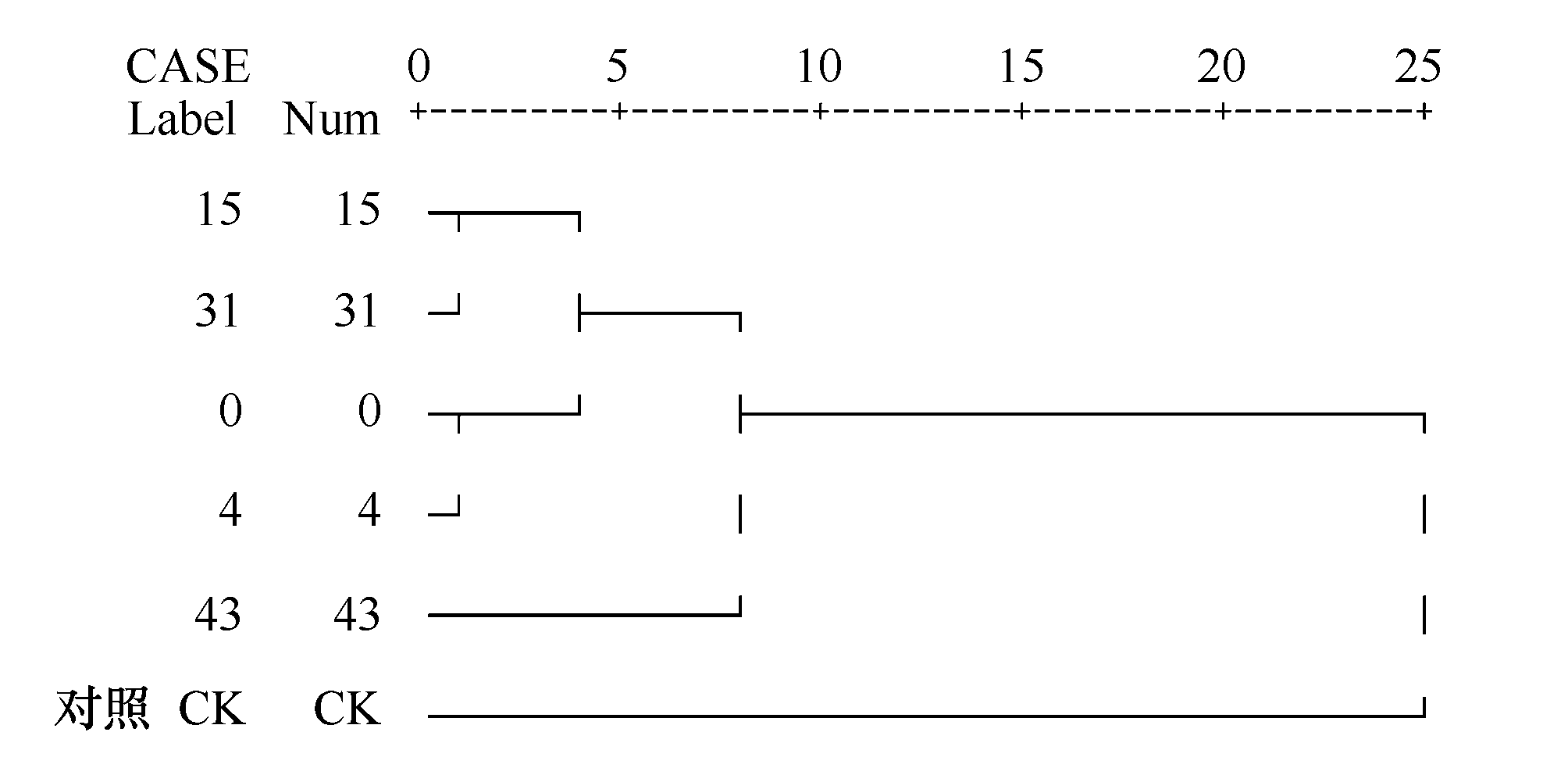
图2 根据土壤酶活和微生物作用对不同演替时期进行层次聚类的分析结果
Fig.2 Cluster analysis at different successional ages according to soil enzyme activities and microbial processes
为了比较不同演替阶段微生物生态特征的差异,根据土壤酶活,对演替时间进行聚类分析,可分为3类。演替0、4、15、31a可聚为一类(图2),说明微生物生态特征在0至31a间相似,属于演替早期;演替15、31a的距离最近,表明微生物生态特征在这期间变化不大。一类是43a,可能属于演替中期。另一类是对照,属于演替晚期。
2.5 微生物过程及酶活与土壤化学性质的关系
土壤有机质与酶活、生物量存在极显著正相关(P<0.01)(表3),表明有机质在微生物活性的变化中起着关键作用。土壤有效氮与酶活、生物量呈显著正相关(P <0.05);生物量和酶活随有机质和有效氮而提高;土壤pH与酶活和生物量呈较弱负相关。以有机质作为控制变量,偏相关的分析结果显示,生物量与有效磷,脲酶与总磷呈较弱负相关。
表3 土壤部分化学性质和微生物生物量和酶活的相关系数
Table 3 Correlation coefficients between soil properties and microbial biomass and enzyme activities
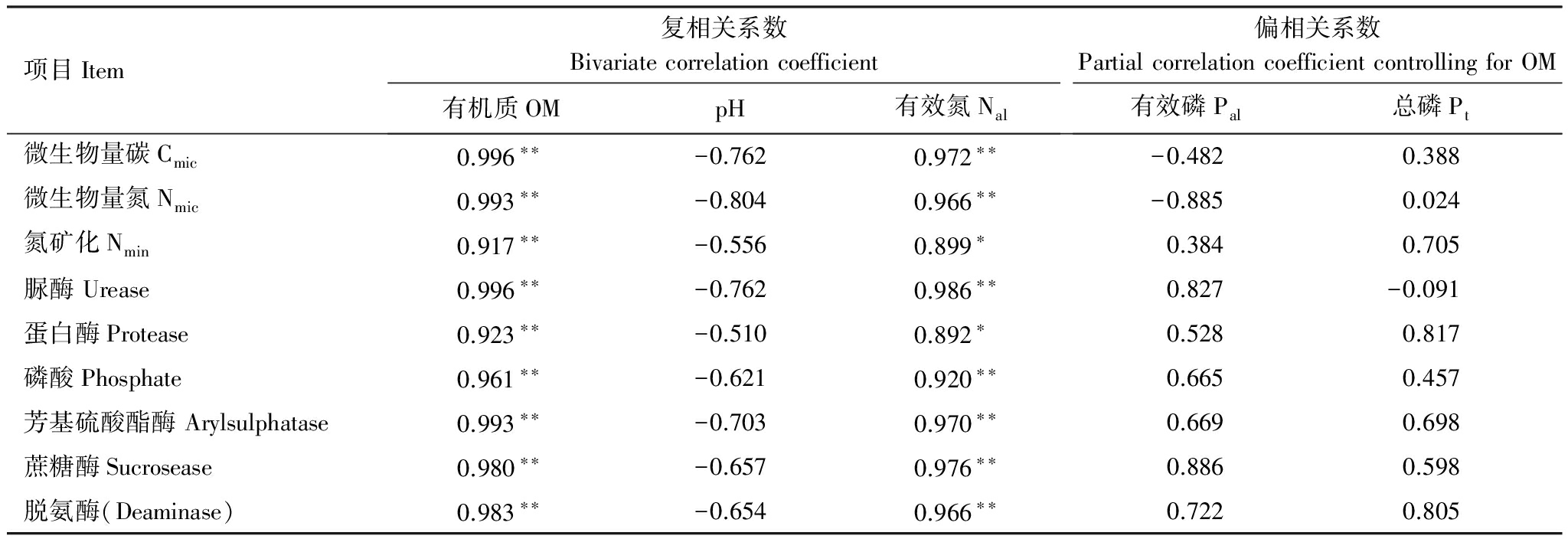
项目Item复相关系数Bivariatecorrelationcoefficient有机质OMpH有效氮Nal偏相关系数PartialcorrelationcoefficientcontrollingforOM有效磷Pal总磷Pt微生物量碳Cmic0.996∗∗-0.7620.972∗∗-0.4820.388微生物量氮Nmic0.993∗∗-0.8040.966∗∗-0.8850.024氮矿化Nmin0.917∗∗-0.5560.899∗0.3840.705脲酶Urease0.996∗∗-0.7620.986∗∗0.827-0.091蛋白酶Protease0.923∗∗-0.5100.892∗0.5280.817磷酸Phosphate0.961∗∗-0.6210.920∗∗0.6650.457芳基硫酸酯酶Arylsulphatase0.993∗∗-0.7030.970∗∗0.6690.698蔗糖酶Sucrosease0.980∗∗-0.6570.976∗∗0.8860.598脱氨酶(Deaminase)0.983∗∗-0.6540.966∗∗0.7220.805
OM:organic matter;Nal:available nitrogen ;Pt:total phosphorus ;Pal:available phosphrous;**差异极显著(P<0.01);*差异显著(P <0.05)
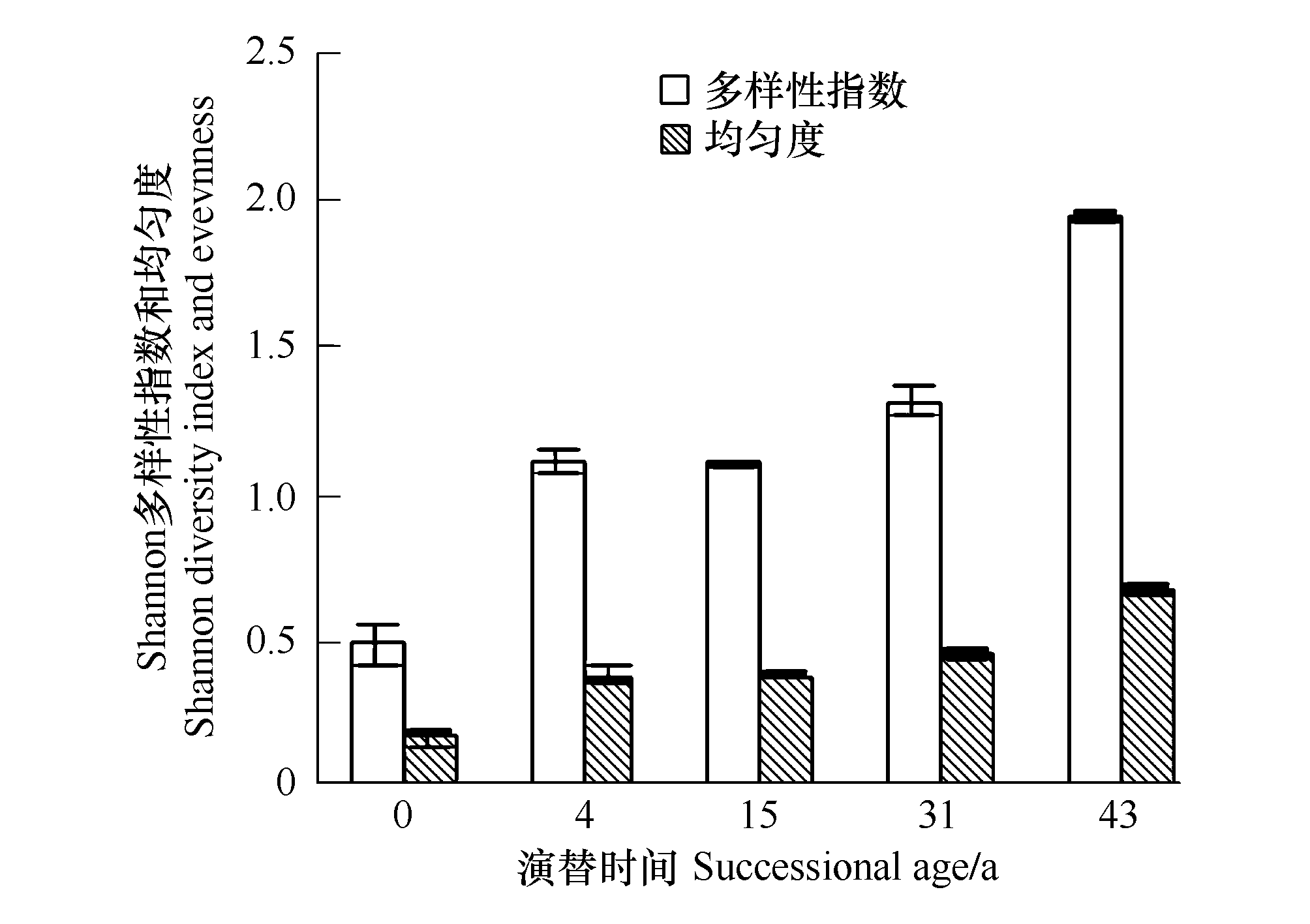
图3 不同演替时间土壤酶活的Shannon多样性指数和均匀度
Fig.3 Shannon diversity index and Shannon eveness of soils along the chronosequence
2.6 Shannon多样性指数和均匀度随演替时间的变化
Shannon多样性指数和均匀度随演替时间而增大(图3),Shannon多样性指数从演替0a的0.49增加至43a的1.95,均匀度从0a的0.17增加至43a的0.67,表明1号冰川前缘微生物多样性随着演替时间而增加,现仍未达稳定状态。
3 讨论
乌鲁木齐河源1号冰川是亚洲干旱及半干旱区冰川的代表,以空间代替时间序列,测定各样带的土壤酶活性、微生物生物量以及氮矿化与脱氨作用,结果表明,在43a的演替过程中,其前缘微生物多样性随时间而增加,现仍未达稳定状态,而奥地利阿尔卑斯中部冰川前缘土壤微生物在原生演替过程中,其功能多样性指数于演替中期(50a)已趋于稳定[15],其原因可能与这两座冰川所处地理位置及气候条件有关。1号冰川地处中亚,地理隔离程度低,与天山山脉一脉相通,沟通了与温带地区的地理联系[27],加之四周被广袤的沙漠包围,亚洲粉尘的东移及1号冰川冷锋和低压的活动,使大气粉尘以湿沉降的方式降落[28],改变了1号冰川前缘土壤的理化性质和养分供给方式,间接影响了酶活及生物量等,而使微生物活性及多样性持续增加至今且未达稳态。
在冰川前缘,微生物的原生演替与土壤发育是同步进行的,随着演替进行,土壤的理化性质也发生相应变化。pH降低,有效磷和有效氮的增加是土壤的发育一般趋势[29]。在风化和成土过程中,微生物是原始土壤有机质的最早来源[30],因此土壤有机质含量随着演替时间而增加,本文结果基本与此一致(表1)。对照土壤的pH值低于其余演替时间,与已有的结论相同[31-32]。相对于国外冰川的研究结果[8,15,33],1号冰川前缘土壤偏碱性且pH值降低不明显,这可能是受温带干旱和半干旱大陆性气候的影响,土壤碳酸钙含量较高[19],阻滞了其酸化[15]。
本研究中有机质与微生物生物量呈极显著正相关,与极地冰川前缘微生物的研究结果类似[34]。Shinpei等人用磷脂脂肪酸分析(PFLA)的方法研究了加拿大high Arctic冰川的微生物演替时也发现随演替时间的增加,微生物生物量与土壤碳和氮(有机质)含量具有正相关的关系[35]。但是此次研究中微生物生物量碳和氮随演替时间呈波动状,趋势不明显,除对照外,其余各样带的微生物生物量变化差异不显著(表2),不同于瑞士Damma冰川前缘微生物生物量持续增加[36],这主要与有机质的分解和积累有关,此外海拔及地貌等条件有可能造成1号冰川前缘空间异质性较高,即使同一样带的重复样品也有较大差异,也是原因之一。
1号冰川前缘土壤酶活变化总体趋势是随演替时间而增加,但15a的硫酸酯酶和磷酸酶高于31a,其余的酶及微生物作用在4a时大于15a。Sigler等人[6]研究冰川前缘细菌演替时,发现其活性在0a至70a间增加,70a至100a间降低,认为样带处的植物种类及数量多寡是主要原因。虽然本研究在4a的样带上发现了零星植物,但未对其种类多样性及根际微生物进行系统研究,所以无法进一步证实此观点。
生物群落演替是其内部关系与外界环境各种生态因子综合作用的结果[37]。与植物相比,微生物的原生演替复杂且漫长,借助于生态特征的变化可了解其演替趋势,而乌鲁木齐河源1号冰川前缘微生物演替过程中的驱动力及营养获得,还有待于进一步研究。
References:
[1]Larocque S J,Smith D J.‘Little Ice Age’proxy glacier mass balance records reconstructed from tree rings in the Mt Waddington area,British Columbia Coast Mountains,Canada.The Holocene,2005,15 (5):748-757.
[2]Sigler W V,Zeyer J.Colony-forming analysis of bacterial community succession in deglaciated soils indicates pioneer stress-tolerant opportunists.Microbial Ecology,2004,48:316-323.
[3]Tian D L.Advanced Ecology.Beijing:Science Press,2008.
[4]Diana R N,Suzanne P A,Cory C C,Andrew P M,Amy E M,Anton S,Steven K S.Microbial community succession in an unvegetated,recently deglaciated soil.Microbial Ecology,2006,53:110-122.
[5]Zhang J E,Hu S X.The development and evolution of landscape in front of alpine glacier---a case study from the front area of No.1 Glacier in Tianshan Mountain.Arid Zone Research,1997,14(4):38-43.
[6]Sigler W V,Crivii S,Zeyer J.Bacterial succession in glacial forefield soils characterized by community structure,activity and opportunistic growth dynamics.Microbial Ecology,2002,44:306-316.
[7]Graeme W N,Tscherko D,Martin T E.Primary succession of soil Crenarchaeota across a receding glacier foreland.Environmental Microbiology,2005,7(3):337-347.
[8]Deiglmary K,Philippot L,Tscherko D,James I P.Microbial succession of nitrate-reducing bacteria in the rhizophere of Poa alpine across a glacier foreland in the Central Alps.Environmental Microbiology,2006,8(9):1600-1612.
[9]Meng L J,Wu F Z.A review of studies on soil enzymology.Journal of Northeast Forestry University,2004,35(5):622-626.
[10]Ding H,Hu H B,Wang R C.The relationship between soil enzyme activity and soil physical-chemical properties or microbial biomass in semi-arid area.Journal of Nanjing Forestry University,2007,31(2):13-18.
[11]Xu H,Liao C Y,Li X M,Sun C Z,Wang Y W,Li L .Soil microorganism and enzyme activities under different artifical sand-fixing vegetations in the sandy area of Yulin.Journal of Northwest Agricultural and Forestry University,2008,36(2):135-141.
[12]Bruce A C.Enzyme activities as a component of soil biodiversity:A review.Pedobiologia,2005,49:637-644.
[13]Dick R P.Long-term effects of agricultural system on soil biochemical and microbial parameters.Agriculture Environmental Microbiology,1992,40:25-36.
[14]Cao Z P,Soil Ecology.Beijing:China Chemistry and Industry Press,2007.
[15]Tscherko D,Rustemeier J,Richter A,Wanek W,Kandeler E .Functional diversity of the soil microflora in primary succession across two glacier forelands in the Central Alps.European Journal of Soil Science,2003,54:685-696.
[16]Jiao K Q,Jing Z F,Han T D,Yang H A,Ye B S,Li Z Q.Variation of the Glacier No.1 at the Headwaters of the Urumqi River in Tianshan Mountains during the past 42 years.Journal of Glaciology and Geocryology,2004,26(3):253-260.
[17]Jiao K Q,Wang C Z,Han T D.A strong negative mass balance appeared in the headewater of the Urumqi River.Journal of Glaciology and Geocryology,2000,22 (1):62-64.
[18]Luo H Z,Hydrochemical features of the Glacier No.1 in the source region of Urumqi River,Tianshan.Journal of Glaciology and Geocryology.1983,5(2):55-64.
[19]Guan S Y.Soil Enzymes and Its Methodology.Beijing:China Agriculture Press,1986.
[20]Cai H,Shen R F.Determination of soil protease activity with modified ninhydrin colorimetry.Acta Pedologica Sinica,2005,42(2):306-313.
[21]Tabatabai M A,Bremner J M.Arylsufatase activity of soils.Soil Science Society American Proceedings,1970,34:225-229.
[22]Lu R K.Soil Agriculture Chemistry Analytical Method.Beijing:China Agriculture Science and Technology Press,1999.
[23]Alef K,Kleiner D.Arginine ammonification,a simple method to estimate microbial activity potentials in soils.Soil Biology and Biochemistry,1986,18:233-235.
[24]Waring S A,Bremner J M.Ammonium production in soil under waterlogged conditions as an index of N availability.Nature,1964,201:951-952.
[25]Vance E D,Brookes P C,Jenkinson D S.An extraction method for measuring soil microbial biomass C.Soil Biology and Biochemistry,1987,19:703-707.
[26]Brookes P C,Landman A,Pruden G,Jenkinson D S.Chloroform fumigation and the release of soil nitrogen:a rapid direct extraction method to measure microbial biomass nitrogen in soil.Soil Biology and Biochemistry,1985,17:837-842.
[27]Wei Y,Tan D Y,Zhu J W.Studies on the flora of seed plants in freezing vegetation zone near Glacier No.1 in Tianshan Mountain.Arid Zone Research,1998,15(1):49-53.
[28]You X N,Li Z Q,Wang F T,Zhu Y M.Seasonal evolution of insoluble microparticals stratigraphy in Glacier No.1 percolation zone,Eastern Tianshan,China.Advances in Earth Science,2006,21(11):1164-1170.
[29]Graeme W N,Dagmar T,Embley T M,James I P.Primary succession of soil Crenarchaeota across a receding glacier forefield.Environmental Microbiology,2005,7(3):337-347.
[30]Huang C Y.Soil Science.Beijing:China Agriculture Press,2000.
[31]Messer A C.Regional variations in rates of pedogenesis and the influence of climate factors on moraine chronosequences,Southern Norway.Arctic and Alpine Research,1988,20:31-39.
[32]Matthias N,Maro W.Changes of the soil ecosystem along a receding glacier:Testing the correlation between environment factors and bacterial community structure.Soil Biology and Biochemistry,2008,8:1-9.
[33]Hammerli A,Waldhuber S,Minici C,Zeyer J,Bunge M.Local expansion and selection of soil bacteria in a glacier forefield.European Journal of Soil Science,2008,58:1437-1445.
[34]Bekku Y S,Nakatsubo T,Kume A,Koizumi H.Microbial biomass in relation to primary succession on Arctic deglaciated moraines.Polar Bioscience,1999,12:47-53.
[35]Shinpei Y,Masaki U,Takayuki N,Hiroshi K.Characterization of soil microflora on a successional glacier foreland in the high Arctic on Ellesmere Island,Nunavut,Canada using phospholipid fatty acid analysis.Polar Bioscience,2006,19:73-84.
[36]Sigler WV,Zeyer J.Micriobial Diversity and activity along the forefields of two receding glaciers.Microbial Ecology,2002,43:397-407.
[37]Cao C G,Yan L J,Liu L M.Ecology Conspectus.Beijing:Higher Education Press,2002.
参考文献:
[3]田大伦.高级生态学.科学出版社,2008.
[5]章家恩,胡双熙.高山冰川前缘地带景观生态的发育与演替——以天山1号冰川前缘为例.干旱区研究,1997,14(4):38-43.
[9]孟立君,吴凤芝.土壤酶学研究进展.东北农业大学学报,2004,35(5):622-626.
[10]丁菡,胡海波,王人潮.半干旱区土壤酶活性与其理化及微生物的关系.南京林业大学学报,2007,31(2):13-18.
[11]徐恒,廖超英,李晓明,孙长忠,王彦武,李亮.榆林沙区人工固沙林土壤微生物生态分布特征及酶活性研究.西北农业科技大学学报,2008,36(12):135-141.
[14]曹志平.土壤生态学.北京:化学工业出版社,2007.
[16]焦克勤,井哲帆,韩添丁,杨慧安,叶柏生,李忠勤.42a来天山乌鲁木齐河源1号冰川变化及趋势预测.冰川冻土,2004,26(3):253-260.
[17]焦克勤,王纯足,韩添丁.天山乌鲁木齐1号冰川新近出现大的物质负平衡.冰川冻土,2000,22(1):62-64.
[18]骆鸿珍.天山乌鲁木齐河源1号冰川的水化学特征.冰川冻土,1983,5(2):55-64.
[19]关松荫.土壤酶及其研究法.北京:农业出版社,1986.
[20]蔡红,沈仁芳.改良茚三酮比色法测定土壤蛋白酶活性的研究.土壤学报,2005,42(2):306-313.
[22]鲁如坤.土壤农业化学分析方法.北京:中国农业科技出版社,1999.
[27]魏岩,谭敦炎,朱建雯.天山1号冰川冻原植被带种子植物区系.干旱区研究,1998,15(1):49-53.
[28]尤晓妮,李忠勤,王飞腾,朱宇曼.乌鲁木齐河源1号冰川不溶微粒的季节变化特征.地球科学进展,2006,21(11):1164-1170.
[30]黄昌勇.土壤学.北京:中国农业出版社,2000.
[37]曹凑贵,严力蛟,刘黎明.生态学概论.北京:高等教育出版社,2002.
Ecological characterization of soil microflora in primary succession across glacier forefield:a case study of Glacier No.1 at the Headwaters of Urumqi River
Abstract:In order to understand ecological characterization and effect factors of soil microflora in primary succession across glacier forefield ,using the space-for-time substitution approach,soil samples along six different succession ages (0,4,15,31,43-year-old and reference)were collected,beginning at the terminal moraine levee of Glacier No.1 at the headwaters of Urumqi River,a site with well-developed soils immediately outside the glacier forefield served as reference,soil enzyme activities,microbial nitrogen mineralization,deamination and microbial biomass were measured.The results suggested that soil urease,protease,acid phosphatase,arylsulphatase,sucrosease activity,microbial nitrogen mineralization and deamination increased along time gradients,microbial biomass carbon and nitrogen were variable,with no clear pattern over the chronosequence.Correlation analysis showed soil enzyme activities and microbial biomass had a significant positive correlation with soil organic matter(P<0.01).Soil microflora diversity index of Glacier NO.1 foreland increased along succession ages,but do not reach stability at present.
Key Words:glacier forefield;primary succession;Glacier No.1;ecological characterization
基金项目:国家973计划前期研究专项(2008CB417214);新疆特殊环境微生物实验室开放课题(XJYS0203-2008-04)
收稿日期:2009-11-24;
修订日期:2010-09-26
*通讯作者Corresponding author.E-mail:loukai02@mail.tsinghua.edu.cn
