沉积有机质微生物降解与生物气源岩识别——以柴达木盆地三湖坳陷第四系为例
【类型】期刊
【作者】王万春,刘文汇,王国仓,王成(甘肃省油气资源研究重点实验室中国科学院油气资源研究重点实验室中国科学院地质与地球物理研究所兰州油气资源研究中心;中国石油化工集团公司油气成藏重点实验室;中国科学院大学)
【作者单位】甘肃省油气资源研究重点实验室中国科学院油气资源研究重点实验室中国科学院地质与地球物理研究所兰州油气资源研究中心;中国石油化工集团公司油气成藏重点实验室;中国科学院大学
【刊名】石油学报
【关键词】 柴达木盆地;生物气;生物标志化合物;微生物降解;气源岩
【资助项】国家自然科学基金项目(No.41172132);甘肃省油气资源研究重点实验室专项(1309RTSA041)资助
【ISSN号】0253-2697
【页码】P318-327
【年份】2019
【期号】第3期
【期刊卷】1;|6;|7;|8;|4;|5;|2
【摘要】生物气的主要组分甲烷是不同微生物菌群协同降解复杂有机质的终端产物,研究生物气生成过程中微生物对沉积有机质降解的生物标志化合物特征,对柴达木盆地东部生物气气源层识别具有重要意义。柴达木盆地三湖坳陷涩北一号气区第四系沉积物饱和烃生物标志化合物的研究发现,一些泥岩层内饱和烃组分遭受微生物降解,使部分正构烷烃和无环类异戊二烯烷烃消失,色谱不可分辨的复杂有机混合物显著升高。微生物降解作用明显的泥岩,降解参数升高,可溶有机质含量与烃转化率也显著升高,反映第四系部分泥岩层中高的可溶有机质含量与烃含量,是微生物活动和降解原始沉积有机质的产物。在微生物降解作用明显的泥岩中,检测到了丰富的产甲烷菌特殊生物标志化合物2,6,10,15,19-五甲基二十烷等,表明降解程度高的泥岩中,不仅厌氧降解细菌活动强烈,产甲烷菌活动也很强烈,是生物气的优质烃源岩。因此可以得出:可溶有机质含量,特别是其中烃含量以及微生物降解参数,是评价生物气气源岩的重要依据。
【全文】 文献传递
沉积有机质微生物降解与生物气源岩识别
——以柴达木盆地三湖坳陷第四系为例
摘要:生物气的主要组分甲烷是不同微生物菌群协同降解复杂有机质的终端产物,研究生物气生成过程中微生物对沉积有机质降解的生物标志化合物特征,对柴达木盆地东部生物气气源层识别具有重要意义。柴达木盆地三湖坳陷涩北一号气区第四系沉积物饱和烃生物标志化合物的研究发现,一些泥岩层内饱和烃组分遭受微生物降解,使部分正构烷烃和无环类异戊二烯烷烃消失,色谱不可分辨的复杂有机混合物显著升高。微生物降解作用明显的泥岩,降解参数升高,可溶有机质含量与烃转化率也显著升高,反映第四系部分泥岩层中高的可溶有机质含量与烃含量,是微生物活动和降解原始沉积有机质的产物。在微生物降解作用明显的泥岩中,检测到了丰富的产甲烷菌特殊生物标志化合物2,6,10,15,19-五甲基二十烷等,表明降解程度高的泥岩中,不仅厌氧降解细菌活动强烈,产甲烷菌活动也很强烈,是生物气的优质烃源岩。因此可以得出:可溶有机质含量,特别是其中烃含量以及微生物降解参数,是评价生物气气源岩的重要依据。
关键词:柴达木盆地;生物气;生物标志化合物;微生物降解;气源岩
引用 :王万春,刘文汇,王国仓,王成.沉积有机质微生物降解与生物气源岩识别——以柴达木盆地三湖坳陷第四系为例[J].石油学报,2016,37(3):318-327.
Cite :Wang Wanchun,Liu Wenhui,Wang Guocang,Wang Cheng.Biodegradation of depositional organic matter and identification of biogenic gas source rocks:an example from the Sanhu depression of Qaidam Basin[J].Acta Petrolei Sinica,2016,37(3):318-327.
柴达木盆地三湖坳陷第四系蕴含着丰富的生物成因天然气资源。生物气(主要为甲烷)是厌氧微生物群降解复杂有机质的终端产物。厌氧微生物降解作用广泛存在于地下,包括油藏、煤层、页岩、现代沉积层等富含有机质的地质环境中[1-3]。上述环境中微生物群厌氧降解复杂有机质,使其成为单个碳的简单有机分子,这些简单分子通过产甲烷古菌生成甲烷,并聚集成天然气藏[3-5]。大多数产甲烷菌都不能直接利用高碳数的有机分子,因此复杂有机质最终转化成为甲烷,需依赖各种微生物菌群的协同降解作用[4-6]。首先,复杂聚合物由发酵菌降解为低聚物和单体化合物,其次,低聚物和单体化合物进一步降解为脂肪酸、有机酸、乙醇、氢以及CO2。分子量较高的发酵产物如脂肪酸等,被互营型细菌进一步降解为乙酸、氢以及CO2,并被产甲烷菌利用生成甲烷[4,7]。
生物甲烷生成的微生物过程与地质条件已得到广泛研究[8,9],并建立了生物气及其微生物生成途径的判识指标[10],但对生物气气源层识别的研究较少[11,12]。对柴达木盆地生物气成因及资源评价已有卓有成效的研究[13-19],但对其生成过程中有机质微生物降解以及产甲烷菌发育的研究较少[20-22]。生物甲烷具有特殊的生成过程,其资源评价方法和标准也有其特殊性。柴达木盆地快速沉积的第四系是三湖坳陷生物气气源岩,对其评价已有诸多研究。帅燕华等[22]通过古细菌醇的分析,认为产甲烷菌活动受盐度控制;并通过生物标志物与地层水盐度对比,认为地下水分布控制着生物甲烷生成[20]。张英等[16]通过可溶有机质丰度研究,认为第四系可溶有机质含量约为不溶有机质的2.6倍,并提出了划分气源岩的标准。梅建森等[23]通过生物模拟产气和生物菌群分布对比研究,认为1 000~1 600 m深度是微生物菌群数量高峰区和甲烷产率高值区。关平等[24]通过有机酸研究,认为第四系生物成因气源岩主要发育在K10标准层以上。陈华强等[25]通过有机质氮同位素组成和蛋白质含量研究,认为蛋白质含量能够表征微生物营养底物的丰度,氮同位素组成可以反映微生物活动强度。上述研究从不同方面探讨了生物气气源岩的识别因素及其评价方法和标准,对三湖坳陷生物气勘探具有深远意义。
生物甲烷是微生物菌群降解沉积有机质的终端产物,柴达木盆地三湖坳陷丰富的生物气资源,说明第四系沉积有机质经历了一系列的微生物降解作用。微生物菌群降解沉积有机质必定在其中残留其活动及降解信息,因此,研究饱和烃生物标志化合物降解指标,揭示降解指标对微生物活动强度表征的潜在意义,是柴达木盆地三湖坳陷生物气气源岩识别研究中需要探讨的科学问题,也是目前较少系统研究的问题。笔者通过对柴达木盆地涩北一号气田区沉积有机质微生物降解特征的研究,探讨了第四系沉积物中饱和烃生物标志化合物降解特征,并揭示其在生物气气源岩识别中的意义。
1 地质背景
柴达木盆地是中国西部中、新生代大型内陆山间盆地,油气资源丰富[26,27],第四系生物气分布在盆地中东部三湖坳陷的湖相沉积中。三湖坳陷在距今约2Ma的地质时期内强烈沉降,快速沉积了巨厚的咸水湖相夹沼泽相的第四系[14],厚度一般为300~3 500 m,其中厚度大于2 000 m的面积约为2.5×104km2,气源岩主要分布在台吉乃尔—涩聂湖一带,呈NWW展布,坳陷中心气源岩厚度大于1 km[15]。第四系暗色泥岩、碳质泥岩中有机质主要是以陆源生物为主的腐殖型和含腐泥腐殖型,有机母质主要为陆生草本植物、水生植物和藻类[15]。第四系沉积有机质处于未成熟阶段,镜质体反射率Ro为0.27%~0.47%[13]。柴达木盆地中东部从现代湖底淤泥沉积直至埋深1 705 m的第四系七个泉组,及新近系狮子沟组岩心中,均有产甲烷菌、发酵性细菌、厌氧纤维素分解菌存活,并且具有生化产甲烷能力[28,29]。第四系天然气是以甲烷为主的干气,甲烷碳同位素值轻于-60‰,属于典型的生物成因天然气[14,30,31]。
柴达木盆地三湖坳陷快速沉积形成的第四系中大量生物甲烷的形成与聚集、厌氧微生物菌群的存在,均表明第四系沉积层中微生物活动强烈,是研究微生物降解沉积有机质的理想场所。
2 样品与实验
在柴达木盆地三湖地区涩北1号气田区,采集了第四系540~1 536 m不同深度的钻孔岩心样品44块,所采样品主要为灰色或深灰色泥岩,少数为碳质泥岩。对样品进行了总有机碳和氯仿沥青“A”及其族组分含量测定,对饱和烃馏分进行了色谱-质谱分析。
样品粉碎至100目以上。粉碎后的样品分别进行有机碳和可溶有机质分析。有机碳分析:称取约1g样品,用5%稀盐酸除去样品中的碳酸盐岩,用CS-344碳-硫分析仪测定有机碳含量。
可溶有机质分析:依据有机碳含量,称取100~200 g样品,用氯仿经索氏抽提72 h,采用活化铜粉去除硫,得到氯仿沥青“A”。氯仿沥青“A”在过量精制石油醚中静止24 h,沉淀沥青质,然后用硅胶-氧化铝层析柱进行柱色谱分离。采用精制石油醚分离饱和烃,二氯甲烷分离芳烃,甲醇分离非烃。饱和烃采用色谱(GC6890N)-质谱(MSD5973N)联用仪分析鉴定。气相色谱采用DB-5毛细管柱( 30 m × 0.25 mm × 0.25 μm),程序升温80~290℃,升温速率4℃/min,恒温40 min,载气用高纯氦,流量1.2 mL/min,线速度40 cm/s,MS用EI源70 ev,温度为230℃进行离子化。杆温150℃,GC-MS系统在全扫描模式下运作,扫描范围为质荷比20~750。
3 结果与讨论
3.1 有机质微生物降解特征及指标
微生物对有机质降解的研究,在油藏研究中较多且详尽,积累了丰富的研究资料,并建立了判识原油降解级别的生物标志化合物参数[1,2,32-41]。原油降解一般以消耗直链正构烷烃开始,其后依次是无环类异戊二烯烷烃、多支链烷烃及环烷烃等[37-39]。这些色谱可分辨化合物的损失导致不可分辨的复杂有机混合物(UCM)的升高[35,39-41]。近年来也有不少与生物甲烷生成有关的降解研究,如与次生生物成因煤层气有关的煤岩有机质降解研究[3,4,9,34,35,42],与油藏次生生物气有关的原油降解研究[2,4],与生物甲烷生成有关的页岩及泥岩有机质降解研究等[3,5,11,12,20]。沉积有机质微生物降解,既有与原油降解相同的特征,如直链正构烷烃首先消耗,造成UCM升高等[3-5,20,34,35],也有其特殊性,如煤岩有机质降解中芳烃的消耗较之原油降解中提前[35]。
前人通过对抗降解能力不同的生物标志化合物对比,建立了判识微生物降解的生标次序,对饱和烃组分而言,依次为正构烷烃、无环类异戊二烯烷烃、甾烷和藿烷[37,39]。抗降解能力不同的生物标志化合物的丰度比值,均可作为降解指标。常用的降解指标有难降解的C31-17α(H)-21β(H)22S和22R藿烷或C30-藿烷相对于易降解的不同碳数分布范围的正构烷烃或无环类异戊二烯烷烃的比值[3,35]。笔者应用的降解指标为C30-藿烷与短链(nC15—nC19)、中链(nC20—nC24)、长链(nC25—nC30)正构烷烃,以及C18—C20的无环类异戊二烯烷烃在TIC谱图上峰面积的比值(表1)。
3.2 有机质含量与烃转化率特征
涩北1号气田区第四系泥岩样品TOC含量为0.10%~2.67%,多数样品为0.20%~0.30%;氯仿沥青“A”含量为0.001 6%~0.146 5%,多数样品低于0.01%。碳质泥岩样品TOC含量为10.90%~19.88%,氯仿沥青“A”含量为0.050 7%~0.229 4%(表1)。部分低TOC含量的泥岩样品,有较高的氯仿沥青“A”含量,如S45号样品,TOC含量为0.30%,氯仿沥青“A”含量高达0.146 5%。
烃源岩中的可溶有机质,来源于原始沉积有机质(如植物、藻类等)、微生物本身及其对沉积有机质的降解、有机质热降解[43]。图1是氯仿沥青“A”中烃(饱和烃+芳烃)转化率(HC/TOC)与TOC含量之间的关系,随TOC含量增加,烃转化率不仅没有升高反而显著降低,与热降解下烃转化率与TOC的关系完全相反。三湖坳陷第四系沉积有机质处于未成熟阶段,因此,TOC含量低的泥岩样品中高含量的氯仿沥青“A”,不是有机质热降解产生的,而可能是微生物活动降解原始沉积有机质产生的。
碳质泥岩中高的氯仿沥青“A”含量,主要与高含量的原始有机母质有关,即主要来源于原始沉积生物体中可溶组分的贡献。其氯仿沥青“A”中,非烃和沥青质组分含量高(55%~95%),饱和烃组分含量很低(仅2%~3%),饱/芳比低(<1)。反映碳质泥岩中的可溶有机质主要为含氮含氧的原始生物体有机质。相反,微生物降解特征明显的泥岩样品,氯仿沥青“A”中饱和烃组分含量高(50%~76%),饱/芳比高(>5),非烃和沥青质组分含量较低(15%~39%,表1)。也表明泥岩中高含量的氯仿沥青“A”是微生物降解原始沉积有机质产生的。由于原始沉积有机质是含氧含氮的复杂聚合物,微生物降解作用不仅可以使这些复杂聚合物,变成简单聚合物而产生烃类[4-6,9],而且微生物(细菌)本身也含有大量的烃类。如一种耐光细菌Vibrio furnissii产生的细胞内与细胞外烃类(C15—C24)含量,能达到该细菌干有机物重量的60%[44]。各种微生物菌群,包括细菌、酵母菌、真菌等,都能够生化生成烃类,如革兰氏阳性菌Clostridium为发酵性细菌,可产生C11—C35的细胞内正构烷烃;革兰氏阴性菌Desulfovibrio desulfuricans为厌氧硫酸盐还原菌,也可产生C11—C35的细胞内正构烷烃[44]。微生物降解特征明显的泥岩样品中,各种微生物菌群发育,因此其中以饱和烃占优势的高含量可溶有机质,主要来源于微生物本身及其对原始有机质的降解。
三湖坳陷第四系TOC含量低的泥岩样品,可溶有机质含量高,烃转化率高,饱和烃总离子流图中正构烷烃大部分消失,具有明显的微生物降解特征;而TOC含量高,烃转化率低的碳质泥岩样品,饱和烃总离子流图中正构烷烃分布完整,微生物降解特征不明显。这一现象表明第四系TOC含量低的泥岩样品中,较高的可溶有机质含量与烃转化率,主要与微生物的丰富及其对沉积有机质的降解有关。

图1 柴达木盆地第四系沉积物中总有机碳与烃转化率关系
Fig .1 Relationship between TOC and HC/TOC of the Quaternary sediments of the Qaidam Basin
3.3 正构烷烃微生物降解特征
饱和烃总离子流图显示,烃转化率高的泥岩样品,正构烷烃和无环类异戊二烯烷烃丰度降低,UCM出现了不同程度的升高,表明遭受了微生物降解。依据Peters等[39]和Wenger等[37]建立的微生物降解级别判
识标准,样品降解指标和UCM升高程度,样品的降解程度大致有几种情形:①泥岩样品S5、S45[图2(a)]、S13、S24和S25[图2(b)],所有降解指标均有升高(表1),UCM大幅升高,表明这些泥岩中微生物活动强烈,正构烷烃与类异戊二烯烷烃大部分已被降解,但甾烷与藿烷基本没有遭受降解,因此尚未达到严重降解程度,属中度—重度降解。②泥岩样品S3、S18和S9等,部分降解指标和UCM明显升高(表1),正构烷烃与类异戊二烯烷烃仅部分被降解,甾烷与藿烷也没有遭受降解,属于轻度—中度降解。③泥岩样品S1[图2(c)]、S17、S16等和碳质泥岩样品S12、S14[图2(d))、S21、S22,部分降解指标有所升高(表1),但UCM基本没有升高,仅部分低碳数正构烷烃被降解,类异戊二烯烷烃基本未降解,属轻微降解。④泥岩样品S7[图2(e)]、S32、S36和S39[图2(f)]等,降解指标没有升高(表1),但UCM有所升高,仅部分正构烷烃与类异戊二烯烷烃被降解,降解程度也为轻度降解。⑤泥岩样品S2、S41、S20和S23等,降解指标和UCM均没有升高(表1),正构烷烃与类异戊二烯烷烃分布完整,没有发生微生物降解。
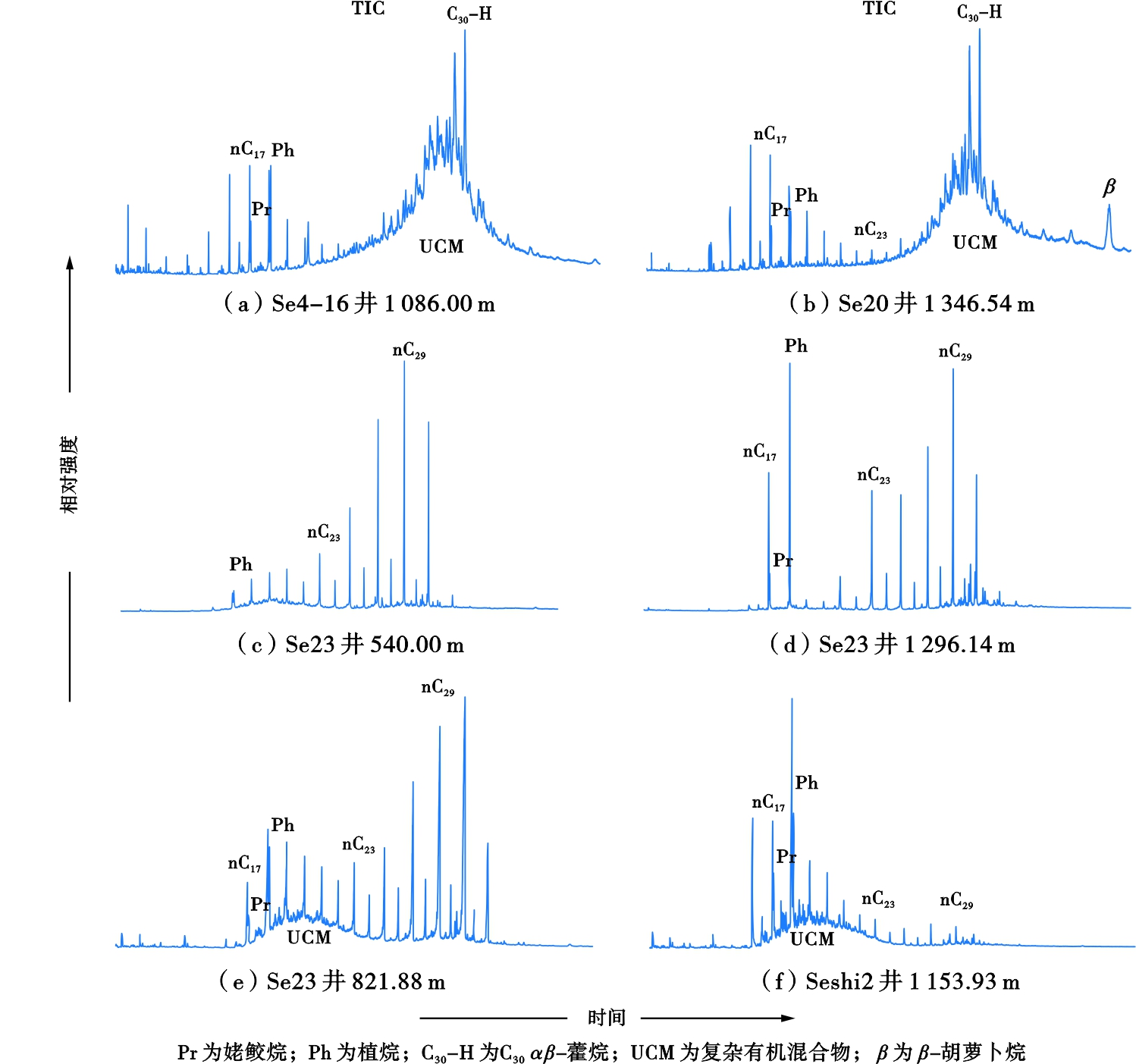
图2 样品总离子流图
Fig .2 TICs of samples
饱和烃总离子流图显示,正构烷烃分布范围为C14—C33,有双峰型、以nC18(或Ph)为主峰的前单峰型和以nC29(nC31)为主峰的后单峰型分布特征(图2)。其中烃转化率高的泥岩样品,正构烷烃呈双峰型分布,后峰高碳数正构烷烃绝大部分被降解,前峰低碳数正构烷烃丰度升高,是微生物降解生物大分子产生短链烃的结果[36];烃转化率低的碳质泥岩样品,正构烷烃以nC29为主峰的后单峰型分布,高碳数正构烷烃基本未降解,低碳数正构烷烃丰度很低。
大部分样品OEP29均较高,其中泥岩样品OEP29在1.44~18.04,碳质泥岩样品OEP29在3.67~8.19。表明正构烷烃具有明显的奇碳优势,反映了有机质未成熟特征和以陆源植物为主的有机母质输入特征[35,45]。除碳质泥岩样品OEP17值高于2.0外,大多数样品OEP17值在0.5~1.4,显示偶碳优势,与微生物降解生物大分子而产生低碳数烷烃有关[36]。另外,随烃转化率升高,低碳数正构烷烃与高碳数正构烷烃的比值(∑nC21-/∑nC22+)升高(图3),也说明低碳数烷烃的产生与微生物的贡献有关。
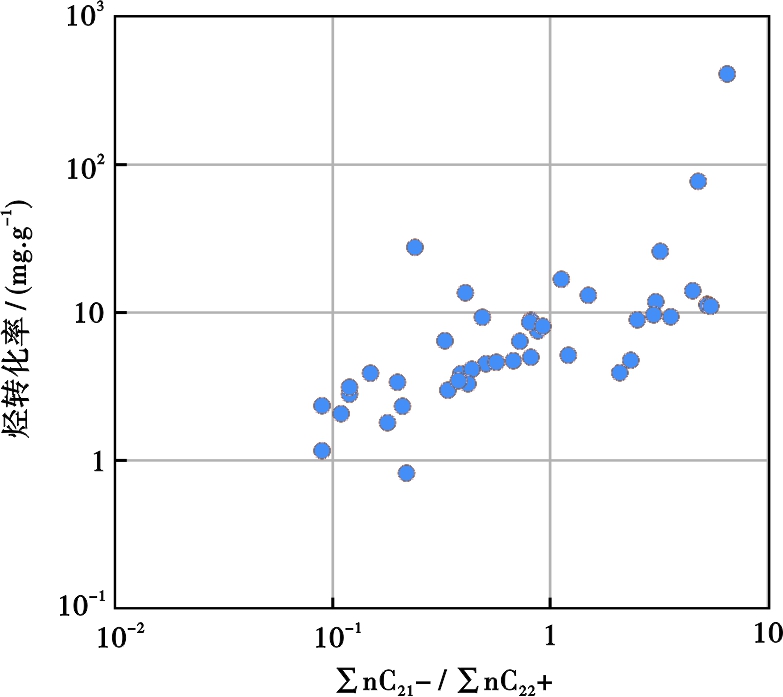
图3 ∑nC21-/∑nC22+比值与烃转化率的关系
Fig .3 Relationship between ∑nC21-/∑nC22+ and HC/TOC ratios
在厌氧并富含有机质的环境中,产甲烷菌不仅可直接利用简单化合物如CO2、H2、乙酸等微生物降解沉积有机质的产物,也可以直接利用烷烃并快速(4~15个月)将其转化为甲烷[5,46-49]。资料显示,在一些产甲烷环境中,烷烃的消失伴随着甲烷的生成,表明存在消耗烷烃和产生甲烷的互营型微生物群[46,48,50-52]。在798.90 m、1 086.00 m、1 290.77 m、1 330.66 m和1 346.54 m层段的泥岩中烷烃明显消失,表明在上述泥岩层中,可能曾经生成过大量甲烷。
降解指标高的样品氯仿沥青“A”含量明显高于降解指标低的样品。特别是有机碳含量较低的泥岩样品,沥青转化率(“A”/TOC)的升高明显与有机质的降解程度有关(图4)。表明未成熟烃源岩中,高含量的可溶有机质,特别是烃类,是微生物活动和降解原始沉积有机物产生的[43,53]。烃类及小分子化合物的产生,为发酵菌类、产酸产氢菌及产甲烷菌提供了营养,为甲烷生成奠定了物质基础。因此,相对于干酪根中的碳,可溶有机质中的碳对于甲烷生成更具意义。这也就不难理解,为何柴达木盆地第四系有机碳丰度低的沉积物,可以生成大量生物甲烷。也说明以传统方法测得的有机碳含量是干酪根有机碳,其含量高低对于评价生物气气源岩并不重要,而可溶有机质含量,特别是其中烃类含量,才是评价生物气气源岩的重要指标。
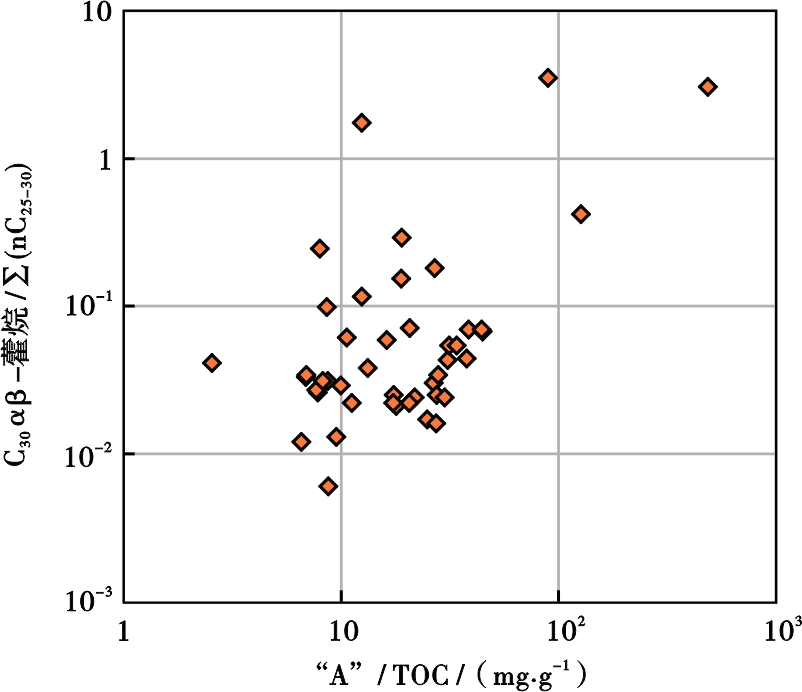
图4 沥青转化率(“A”/TOC)与降解参数的关系
Fig .4 Relationship between “A”/TOC and C30αβ-hopane/
∑nC25-30) ratios
碳质泥岩样品中,仅短链正构烷烃降解参数升高,而微生物降解特征明显的泥岩样品,短链、中链和长链正构烷烃以及无环类异戊二烯烷烃降解参数均显著升高,说明碳质泥岩中仅短链正构烷烃发生了降解。由于碳质泥岩中氯仿沥青“A”含量高,即使仅短链正构烷烃降解,对生物甲烷的生成也可能有较大贡献。故碳质泥岩也可能是较好的生物气气源岩。
3.4 无环类异戊二烯烷烃特征与产甲烷菌
无环类异戊二烯烷烃降解指标在泥岩样品S3、S5、S45、S13、S24和S25中升高(表1),Ph/nC18比值也明显升高,反映上述样品发生了微生物降解。在TOC含量高的碳质泥岩样品中,Ph/nC18比值也很高,造成这种现象的原因可能是:①短链正构烷烃发生了降解;②厌氧条件下微生物活动产生了植烷[54];③有机质以高等植物来源为主,使nC18等低碳数烷烃丰度相对较低。
产甲烷菌属于古菌类微生物,相比其他类型微生物,这类微生物具有显著不同的生物化学组成特征,其细胞壁类脂物中具有类异戊二烯结构。一些特殊的生物标志化合物,如2,6,10,15,19-五甲基二十烷烃(PME),2,6,10,15,19,23-六甲基二十四烷烃(角鲨烷),头-头链接的C38—C40无环类异戊二烯烷烃,是产甲烷菌的特征标志化合物[55-62]。在多数泥岩样品中,检测到了PME和角鲨烷,在降解程度较高的泥岩样品中,PME(iC25)、角鲨烷(iC30)和头-头链接的C38—C40无环类异戊二烯烷烃(iC38—iC40)的丰度较高(表1,图5),反映产甲烷菌发育。角鲨烷(iC30)与其邻近正构烷烃(nC26)的比值(iC30/nC26),在微生物降解参数高的泥岩样品中也较高(图6)。表明降解程度高的泥岩层中,不仅厌氧降解细菌活动强烈,产甲烷菌活动也很强烈。
3.5 烃源岩矿物组成与有机质微生物降解
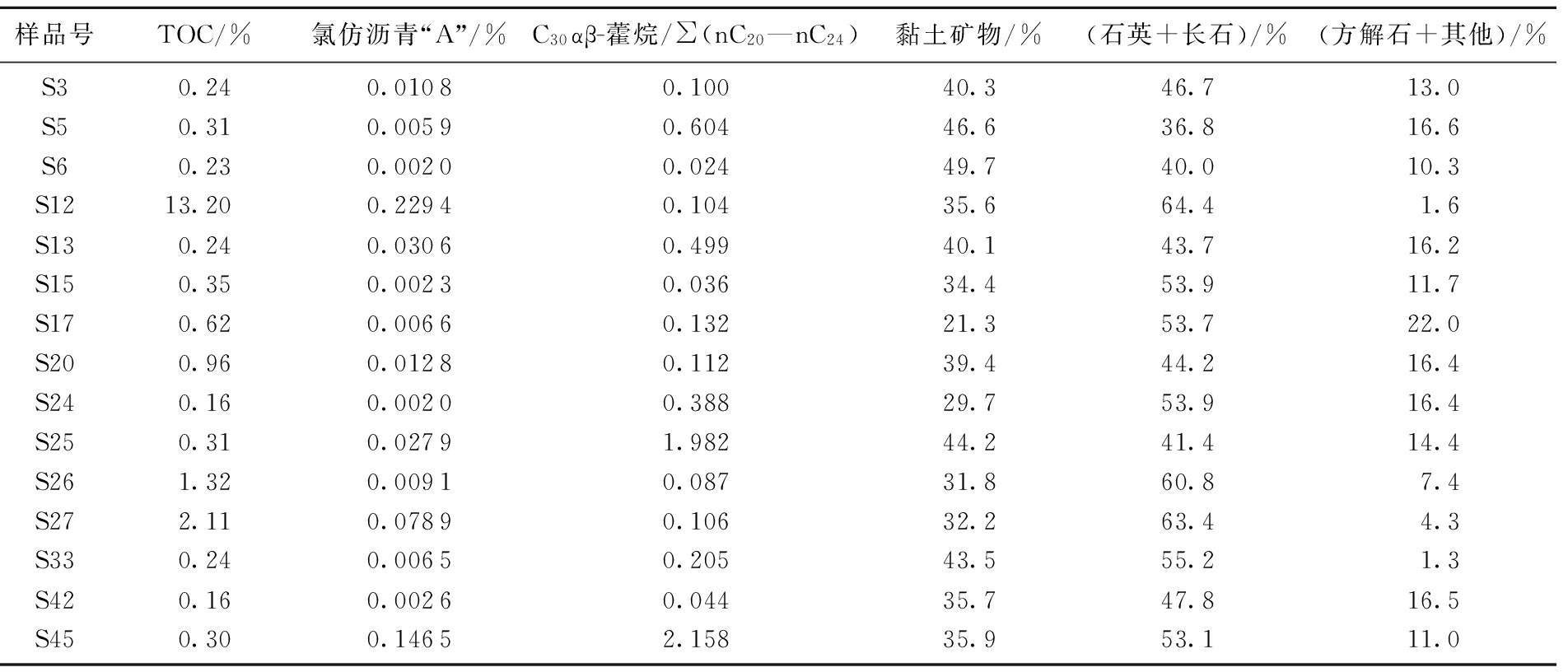
生物降解作用可表征微生物活跃程度,但微生物活跃程度是否与烃源岩中砂质及泥质矿物含量有关。为明确这个问题,笔者分析了部分样品的矿物含量(表2)。
多数样品砂质矿物含量高,属于泥质砂岩,少数样品泥质矿物含量高,属于砂质泥岩。降解参数C30αβ-藿烷/∑(nC20-nC24)高的样品,砂质矿物含量在36.8%~53.9%,降解参数C30αβ-藿烷/∑(nC20-nC24)低的样品,砂质矿物含量在40.0%~60.8%,没有明显差异。因此,就柴达木盆地第四系沉积物而言,不同类型矿物含量对微生物降解的影响较小。
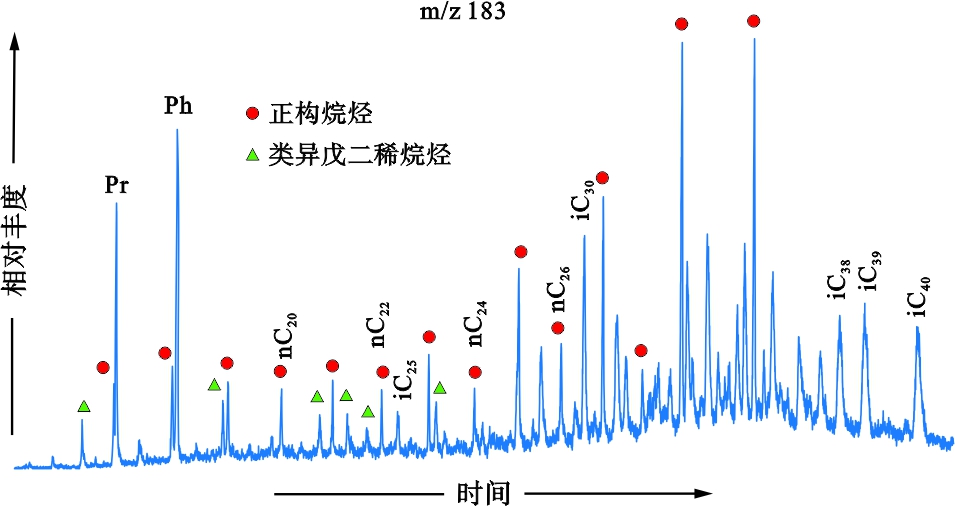
图5 样品S5(798.90 m),质荷比为183质量色谱图
Fig .5 M/z 183 mass fragmentogram of sample S5(798.90 m)
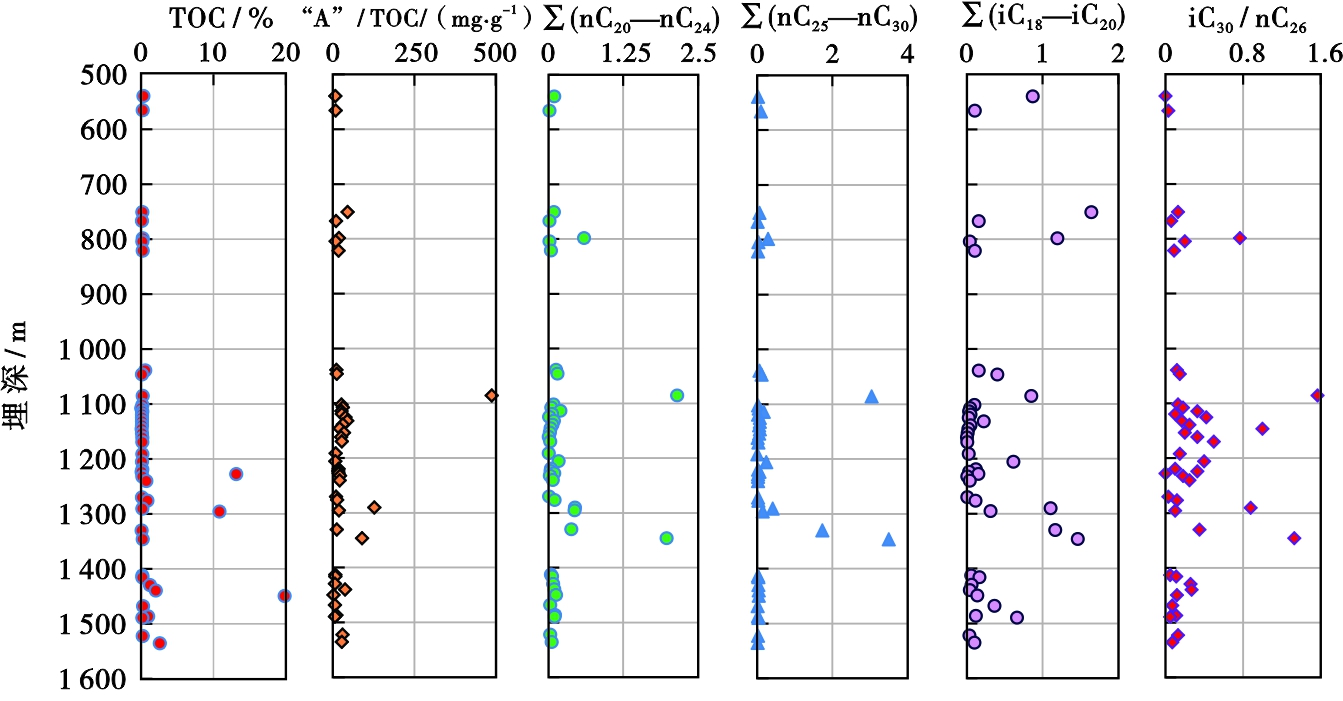
图6 有机质丰度与降解参数在各深度分布
Fig .6 Depth distribution of organic matter abundance and biodegradation parameters
表2 第四系沉积物矿物含量
Table 2 Mineral content of the Quaternary sediments
样品号TOC/%氯仿沥青“A”/%C30αβ-藿烷/∑(nC20—nC24)黏土矿物/%(石英+长石)/%(方解石+其他)/%S30.240.01080.10040.346.713.0S50.310.00590.60446.636.816.6S60.230.00200.02449.740.010.3S1213.200.22940.10435.664.41.6S130.240.03060.49940.143.716.2S150.350.00230.03634.453.911.7S170.620.00660.13221.353.722.0S200.960.01280.11239.444.216.4S240.160.00200.38829.753.916.4S250.310.02791.98244.241.414.4S261.320.00910.08731.860.87.4S272.110.07890.10632.263.44.3S330.240.00650.20543.555.21.3S420.160.00260.04435.747.816.5S450.300.14652.15835.953.111.0
3.6 生物气气源岩识别
对于原油和热成因天然气烃源岩评价,关键的指标是有机碳含量、有机质类型和烃源岩热演化程度。生物成因天然气与热成因天然气的形成机制截然不同,生物成因天然气依靠微生物群对原始沉积有机质持续降解产生。因此,识别与评价生物气气源岩,首先需确定烃源岩中是否有微生物发育迹象,其次确定微生物发育强度。
微生物菌群在厌氧降解复杂有机质并最终生成甲烷的过程中,在源岩中残留了其降解信息,即微生物降解的生物标志化合物参数,产甲烷菌活动则在源岩中残留了其特征标志物信息,这些降解参数及产甲烷菌的特征标志物,是生物气气源岩识别与评价的有用指标。图6表明,所有降解指标在798.90 m、1 086.00 m、1 290.77 m、1 330.66 m和1 346.54 m深度的泥岩样品中均有升高,沥青转化率也明显升高,反映其中微生物降解作用明显。上述层段PME(iC25)和角鲨烷(iC30)在色谱可识别化合物中的相对丰度较高(表1),反映产甲烷菌发育。说明其是生物气生成的优质烃源层段。部分降解指标在751.48 m、1 046.75 m、1 205.98 m、1 228.00 m、1 296.14 m、1 490.00 m等深度的泥岩样品和碳质泥岩样品中有所升高,UCM在821.88 m、1 108.20 m、1 132.36 m和1 153.93 m等深度的泥岩样品中明显升高,上述层段沥青转化率也有所升高,是利于生物气生成的沉积层段。上述层段分别与涩北一号气田区第1、第2和第3气层组深度[63]吻合。在570~760 m和830~1 000 m深度没有采集到样品,但这些层段分别是第0气层组与第1气层组发育段[63],沉积有机质很可能也存在微生物降解现象,值得进一步研究。
4 结 论
(1) 依据饱和烃生物标志化合物特征,样品微生物降解可分为中度—重度降解、轻度—中度降解、轻微降解和未降解4类;中度—重度降解样品,正构烷烃和无环类异戊二烯烷烃大部分消失,UCM显著升高;轻度—中度降解样品,正构烷烃和无环类异戊二烯烷烃丰度明显降低,UCM升高;轻微降解样品,正构烷烃丰度有所降低,UCM有所升高;未降解样品,正构烷烃分布完整,UCM很低。
(2) 可溶有机质含量与烃转化率随降解参数升高而升高,反映微生物降解作用明显的泥岩样品中,高的可溶有机质含量及其中高的烃含量,不是热降解作用产生的,而主要是微生物活动和微生物降解原始沉积有机质产生的。
(3) 低碳数正构烷烃与高碳数正构烷烃的比值(∑nC21-/∑nC22+)随烃转化率和降解参数升高而升高,表明低碳数烷烃是微生物降解高碳数烷烃及其他复杂有机质的产物。
(4) 降解程度较高的泥岩样品中,检测到了PME、角鲨烷和头-头链接的C38—C40无环类异戊二烯烷烃,表明降解程度高的泥岩层中,产甲烷菌的活动也很强烈。
(5) 烃源岩中可溶有机质含量,特别是烃转化率、微生物降解参数以及产甲烷菌的特征标志物,是评价微生物气源岩的重要指标。
参考文献:
[1] Head I M,Jones D M,Larter S R.Review article biological activity in the deep subsurface and the origin of heavy oil[J].Nature,2003,426(6964):344-352.
[2] Jones D M,Head I M,Gray N D,et al.Crude-oil biodegradation via methanogenesis in subsurface petroleum reservoirs[J].Nature,2008(7175),451:176-180.
[3] Gao Ling,Brassell S C,Mastalerz M,et al.Microbial degradation of sedimentary organic matter associated with shale gas and coalbed methane in eastern Illinois Basin (Indiana),USA[J].International Journal of Coal Geology,2013,107:152-164.
[4] Meslé M,Dromart G,Oger P.Microbial methanogenesis in subsurface oil and coal[J].Research in Microbiology,2013,164(9):959-972.
[5] Schlegel M E,McIntosh J C,Petsch S T,et al.Extent and limits of biodegradation by in situ methanogenic consortia in shale and formation fluids[J].Applied Geochemistry,2013,28:172-184.
[6] Jones E J P,Voytek M A,Corum M D,et al.Stimulation of methane generation from nonproductive coal by addition of nutrients or a microbial consortium[J].Applied and Environmental Microbiology,2010,76(21):7013-7022.
[7] Schink B,Stams A J M.Syntrophism among prokaryotes[M]∥Dworkin M,Falkow S,Rosenberg E.The Prokaryotes.3rd ed.New York:Springer,2006:309-335.
[8] Rice D D.Controls,habitat,and resource potential of ancient bacterial gas [M]∥Vially R.Bacterial Gas.Paris:Editions Technip,1992:91-118.
[9] Strą![]() D,Mastalerz M,Schimmelmann A,et al.Variability of geochemical properties in a microbially dominated coalbed gas system from the eastern margin of the Illinois Basin,USA[J].International Journal of Coal Geology,2008,76(1/2):98-110.
D,Mastalerz M,Schimmelmann A,et al.Variability of geochemical properties in a microbially dominated coalbed gas system from the eastern margin of the Illinois Basin,USA[J].International Journal of Coal Geology,2008,76(1/2):98-110.
[10] Whiticar M J,Faber E,Schoell M.Biogenic methane formation in marine and freshwater environments:CO2 reduction vs.acetate fermentation—isotope evidence[J].Geochimica et Cosmochimica Acta,1986,50(5):693-709.
[11] Noble R A,Henk Jr.F H.Hydrocarbon charge of a bacterial gas field by prolonged methanogenesis:an example from the East Java Sea,Indonesia[J].Organic Geochemistry,1998,29(1/3):301-314.
[12] Zhang Shuichang,Li Maowen,Shuai Yanhua,et al.Biogeochemical identification of the Quaternary biogenic gas source rock in the Sanhu depression,Qaidam Basin[J].Organic Geochemistry,2014,73:101-108.
[13] 周翥虹,周瑞年,管志强.柴达木盆地东部第四系气源岩地化特征与生物气前景[J].石油勘探与开发,1994,21(2):30-36.
Zhou Zhuhong,Zhou Ruinian,Guan Zhiqiang.Geochemical properties of source materials and biogas prospects of the Quaternary gas in east of Qaidam Basin[J].Petroleum Exploration & Development,1994,21(2):30-36.
[14] 张晓宝,徐自远,段毅,等.柴达木盆地三湖地区第四系生物气的形成途径与运聚方式[J].地质论评,2003,49(2):168-174.
Zhang Xiaobao,Xu Ziyuan,Duan Yi,et al.Metabolic pathway of the Quaternary biogenetic gases and their migration and accumulation in the Qaidam Basin,China[J].Geological Review,2003,49(2):168-174.
[15] 魏国齐,刘德来,张英,等.柴达木盆地第四系生物气形成机理、分布规律与勘探前景[J].石油勘探与开发,2005,32(4):84-89.
Wei Guoqi,Liu Delai,Zhang Ying,et al.Formation mechanism,distribution feature and exploration prospect of the Quaternary biogenic gas in Qaidam Basin,NW China[J].Petroleum Exploration & Development,2005,32(4):84-89.
[16] 张英,李剑,张奎,等.柴达木盆地三湖地区第四系生物气源岩中可溶有机质丰度及地质意义[J].地质学报,2007,81(12):1716-1722.Zhang Ying,Li Jian,Zhang Kui,et al.Organic matter abundance in Quaternary source rocks and its application on assessment of biogenic gas in Sanhu lake area,Qaidam Basin[J].Acta Geologica Sinica,2007,81(12):1716-1722.
[17] Dang Yuqi,Zhao Wenzhi,Su Aiguo,et al.Biogenic gas systems in eastern Qaidam Basin[J].Marine and Petroleum Geology,2008,25(4/5):344-356.
[18] 李明诚,李剑,张凤敏,等.柴达木盆地三湖地区第四系生物气运聚成藏的定量研究[J].石油学报,2009,30(6):809-815.
Li Mingcheng,Li Jian,Zhang Fengmin,et al.Quantitative research on biogas migration-accumulation and pool-forming in the Quaternary of Sanhu area in Qaidam Basin[J].Acta Petrolei Sinica,2009,30(6):809-815.
[19] 郭泽清,孙平,徐子远,等.柴达木盆地三湖地区第四系岩性气藏形成的主控因素[J].石油学报,2011,32(6):985-990.
Guo Zeqing,Sun Ping,Xu Ziyuan,et al.Controlling factors of Quaternary lithologic gas reservoirs in the Sanhu area,Qaidam Basin[J].Acte Petrolei Sinica,2011,32(6):985-990.
[20] Shuai Yanhua,Zhang Shuichang,Grasby S E,et al.Controls on biogenic gas formation in the Qaidam Basin,northwestern China[J].Chemical Geology,2013,335:36-47.
[21] Shuai Yanhua,Zhang Shuichang,Su Aiguo,et al.Geochemical evidence for strong ongoing methanogenesis in Sanhu region of Qaidam Basin[J].Science in China Series D:Earth Sciences,2010,53(1):84-90.
[22] 帅燕华,张水昌,赵文智,等.古菌细胞膜类脂化合物分析与初步应用——柴达木盆地沉积地层盐度与产甲烷菌分布[J].地质学报,2007,81(1):16-22.Shuai Yanhua,Zhang Shuichang,Zhao Wenzhi,et al.Analysis of methanogen membrane lipids and its application to Sanhu depression,Qaidam Basin[J].Acta Geologica Sinica,2007,81(1):16-22.
[23] 梅建森,康毅力,张永高,等.柴达木盆地生物气源岩评价及勘探方向[J].天然气工业,2007,27(9):17-20.
Mei Jiansen,Kang Yili,Zhang Yonggao,et al.Biogas source rock evaluation in the Qaidam Basin and its exploration target [J].Natural Gas Industry,2007,27(9):17-20.
[24] 关平,王大锐,黄第藩.柴达木盆地东部生物气与有机酸地球化学研究[J].石油勘探与开发,1995,22(3):41-45.Guan Ping,Wang Darui,Huang Difan.Geochemical characteristics of the biogenic gas and organic acids,Eastern Qaidam Basin[J].Petroleum Exploration and Development,1995,22(3):41-45.
[25] 陈华强,于赤灵,卢鸿,等.有机质氮同位素与蛋白质含量在生物气源岩评价中的应用——以柴达木盆地涩北一号构造带为例[J].石油天然气学报:江汉石油学院学报,2011,33(1):21-25.
Chen Huaqiang,Yu Chiling,Lu Hong,et al.Application of organic nitrogen isotopes and protein content in evaluating biological gas source rocks[J].Journal of Oil and Gas Technology:J.JPI,2011,33(1):21-25.
[26] 范昌育,王震亮,王爱国,等.柴达木盆地北缘鄂博梁构造带超压形成机制与高压气水层成因[J].石油学报,2015,36(6):699-706,714.Fan Changyu,Wang Zhenliang,Wang Aiguo,et al.Mechanisms for overpressure generation and origin of overpressured gas and aquifer layers,Eboliang structure belt,northern Qaidam Basin[J].Acta Petrolei Sinica,2015,36(6):699-706,714.
[27] 汤国民,罗群,庞雄奇,等.柴西地区南翼山构造天然气来源及成藏模式[J].石油学报,2015,36(4):446-456.
Tang Guomin,Luo Qun,Pang Xiongqi,et al.Origin and accumulation model of natural gas in Nanyishan structure of western Qaidam Basin[J].Acta Petrolei Sinica,2015,36(4):446-456.
[28] 党玉琪,侯泽生,徐子远,等.柴达木盆地生物气成藏条件[J].新疆石油地质,2003,24(5):374-378.
Dang Yuqi,Hou Zesheng,Xu Ziyuan,et al.The conditions for biogas accumulation in Qaidam Basin[J].Xinjiang Petroleum Geology,2003,24(5):374-378.
[29] 邓宇,张辉,钱贻伯,等.柴达木盆地东部第四系某钻孔沉积物中厌氧细菌的组成与分布[J].沉积学报,1996,14(增刊1):220-226.
Deng Yu,Zhang Hui,Qian Yibai,et al.The composition and distribution of some kinds of anaerobic microorganisms in the Quaternary deposits of east in Qaidam Basin[J].Acta Sedimentologica Sinica,1996,14(S1):220-226.
[30] 顾树松,周翥虹.柴达木盆地东部第四系天然气地球化学特征与分类[J].天然气工业,1993,13(2):1-6.
Gu Shusong,Zhou Zhuhong.Geochemical characteristics and classification of natural gas in quaternary in the east part of Chaidamu Basin[J].Natural Gas Industry,1993,13(2):1-6.
[31] 张英,李志生,王东良,等.柴达木盆地东部天然气地球化学特征与勘探方向[J].石油勘探与开发,2009,36(6):693-701.Zhang Ying,Li Zhisheng,Wang Dongliang,et al.Geochemical characteristics and play targets of gas in eastern Qaidam Basin,NW China[J].Petroleum Exploration and Development,2009,36(6):693-701.
[32] Larter S,Huang Haiping,Adams J,et al.A practical biodegradation scale for use in reservoir geochemical studies of biodegraded oils[J].Organic Geochemistry,2012,45:66-76.
[33] Bennett B,Adams J J,Gray N D,et al.The controls on the composition of biodegraded oils in the deep subsurface-Part 3.The impact of microorganism distribution on petroleum geochemical gradients in biodegraded petroleum reservoirs[J].Organic Geochemistry,2013,56:94-105.
[34] Klein D A,Flores R M,Venot C,et al.Molecular sequences derived from Paleocene Fort Union Formation coals vs.associated produced waters:implications for CBM regeneration [J].International Journal of Coal Geology,2008,76(1/2):3-13.
[35] Formolo M J,Martini A M,Petsch S T.Biodegradation of sedimentary organic matter associated with coalbed methane in the Powder River and San Juan Basins,U.S.A.[J].International Journal of Coal Geology,2008,76(1/2):86-97.
[36] Strą![]() D,Mastalerz M,Dawson K,et al.Biogeochemistry of microbial coal-bed methane[J].Annual Review of Earth and Planetary Sciences,2011,39:617-656.
D,Mastalerz M,Dawson K,et al.Biogeochemistry of microbial coal-bed methane[J].Annual Review of Earth and Planetary Sciences,2011,39:617-656.
[37] Wenger L M,Davis C L,Isaksen G H.Multiple controls on petroleum biodegradation and impact on oil quality[J].SPE Reservoir Evaluation & Engineering,2002,5(5):375-383.
[38] Peters K E,Moldowan J M.The biomarker guide:interpreting molecular fossils in petroleum and ancient sediments[M].New Jersey:Prentice-Hall,1993:1-363.
[39] Peters K E,Walters C C,Moldowan J M.The biomarker guide II:biomarkers and isotopes in petroleum exploration and earth history[M].2nd ed.Cambridge:Cambridge University Press,2005:1-680.
[40] Rabus R.Biodegradation of hydrocarbons under anoxic conditions[M]∥Ollivier B,Magot M.Petroleum Microbiology.Washington D C:American Society for Microbiology ASM-Press,2005:277-299.
[41] Ross A S,Farrimond P,Erdmann M,et al.Geochemical compositional gradients in a mixed oil reservoir indicative of ongoing biodegradation[J].Organic Geochemistry,1996,41(3):307-320.
[42] Ahmed M,Smith J W.Biogenic methane generation in the degradation of eastern Australian Permian coals[J].Organic Geochemistry,2001,32(6):809-816.
[43] Widdel F,Rabus R.Anaerobic biodegradation of saturated and aromatic hydrocarbons[J].Current Opinion in Biotechnology,2001,12(3):259-276.
[44] Ladygina N,Dedyukhina E G,Vainshtein M B.A review on microbial synthesis of hydrocarbons[J].Process Biochemistry,2006,41(5):1001-1014.
[45] Tissot B P,Welte D H.Petroleum formation and occurrence[M].2nd ed.Berlin:Springer-Verlag,1984:1-699.
[46] Anderson R T,Lovley D R.Biogeochemistry:hexadecane decay by methanogenesis[J].Nature,2000,404(6779):722-723.
[47] Gieg L M,Duncan K E,Suflita J M.Bioenergy production via microbial conversion of residual oil to natural gas[J].Applied and Environmental Microbiology,2008,74(10):3022-3029.
[48] Townsend G T,Prince R C,Suflita J M.Anaerobic oxidation of crude oil hydrocarbons by the resident microorganisms of a contaminated anoxic aquifer[J].Environmental Science & Technology,2003,37(22):5213-5218.
[49] Zengler K,Richnow H H,Roselló-Mora R,et al.Methane formation from long-chain alkanes by anaerobic microorganisms[J].Nature,1999,401(6750):266-269.
[50] Grossi V,Raphel D,Hirschler-Réa A,et al.Anaerobic biodegradation of pristane by a marine sedimentary bacterial and/or archaeal community[J].Organic Geochemistry,2000,31(7/8):769-772.
[51] So C M,Young L Y.Anaerobic biodegradation of alkanes by enriched consortia under four different reducing conditions[J].Environmental Toxicology and Chemistry,2001,20(3):473-478.
[52] Siddique T,Fedorak P M,Foght J M.Biodegradation of short-chain n-alkanes in oil sands tailings under methanogenic conditions[J].Environmental Science & Technology,2006,40(17):5459-5464.
[53] Strą![]() D,Picardal F W,Turich C,et al.Methane-producing microbial community in a coal bed of the Illinois Basin[J].Applied and Environmental Microbiology,2008,74(8):2424-2432.
D,Picardal F W,Turich C,et al.Methane-producing microbial community in a coal bed of the Illinois Basin[J].Applied and Environmental Microbiology,2008,74(8):2424-2432.
[54] Wang Ruiliang.Acyclic isoprenoids-molecular indicators of archaeal activity in contemporary and ancient Chinese saline/hypersaline environments[J].Hydrobiologia,1998,381(1/3):59-76.
[55] Greenwood P F,Summons R E.GC-MS detection and significance of crocetane and pentamethylicosane in sediments and crude oils[J].Organic Geochemistry,2003,34(8):1211-1222.
[56] Manquin B P,Morgan J A,Ju J,et al.Production of C35 isoprenoids depends on H2 availability during cultivation of the hyperthermophile Methanococcus jannaschii[J].Extremophiles,2004,8(1):13-21.
[57] Petrov A A,Vorobyova N S,Zemskova Z K.Isoprenoid alkanes with irregular “head-to-head” linkages[J].Organic Geochemistry,1990,16(4/6):1001-1005.
[58] Russell M,Grimalt J O,Hartgers W A,et al.Bacterial and algal markers in sedimentary organic matter deposited under natural sulphurization conditions (Lorca Basin,Murcia,Spain)[J].Organic Geochemistry,1997,26(9/10):605-625.
[59] Schouten S,van der Maarel M J E C,Huber R,et al.2,6,10,15,19-Pentamethylicosenes in methanolobus bombayensis,a marine methanogenic archaeon,and in methanosarcina mazei[J].Organic Geochemistry,1997,26(5/6):409-414.
[60] Schouten S,Hoefs M J L,Koopmans M P,et al.Structural characterization,occurrence and fate of archaeal ether-bound acyclic and cyclic biphytanes and corresponding diols in sediments[J].Organic Geochemistry,1998,29(5/7):1305-1319.
[61] Stefanova M.Head-to-head linked isoprenoids in Miocene coal lithotypes[J].Fuel,2000,79(7):755-758.
[62] Thiel V,Peckmann J,Seifert R,et al.Highly isotopically depleted isoprenoids:molecular markers for ancient methane venting[J].Geochimica et Cosmochimica Acta,1999,63(23/24):3959-3966.
[63] 管志强,徐子远,周瑞年,等.柴达木盆地第四系生物气的成藏条件及控制因素[J].天然气工业,2001,21(6):1-5.
Guan Zhiqiang,Xu Ziyuan,Zhou Ruinian,et al.The essential conditions and controlling factors of formation of Quaternary biogenic gas reservoirs[J].Natural Gas Industry,2001,21(6):1-5.
Biodegradation of depositional organic matter and identification of biogenic gas source rocks:an example from the Sanhu depression of Qaidam Basin
Abstract:The major component of biogenic gas, methane, is an important end product of biogeochemical processes associated with degradation of complex sedimentary organic matter by communities of microbes. Efforts to better understand the characteristics of biomarkers as a result of biodegradation of sedimentary organic matter during gas generation are therefore valuable in assessing and constraining the potential of mudstone as source rocks for biogenic gas in the eastern Qaidam Basin. Based on the study of biomarkers in saturated hydrocarbons of the Quaternary sediments from the Sebei 1 gas field in the Sanhu depression of the Qaidam Basin, it is found that saturated hydrocarbons in some mudstone samples were biodegraded and resulted in a partial removal of n-alkanes and acyclic isoprenoids and a significant increase in the “unresolved complex mixture”. Mudstone samples undergone obvious biodegradation processes show increased biodegradation index and remarkable increase in the contents of soluble organic matter and hydrocarbon conversion ratios, suggesting that the high contents of soluble organic matter and hydrocarbons in some of the Quaternary mudstone layers are the results of microbial activities and biodegradation of original sedimentary organic matter. Abundant particular biomarkers for methanogens, such as 2,6,10,15,19-pentamethylicosane, were detected in mudstone samples undergone obvious biodegradation processes, indicating that both methanogenic archaea and anaerobic bacteria intensely developed in these sediments and they are therefore proposed to be excellent biogenic gas source rocks. It is the contents of soluble organic matter and hydrocarbons and biodegradation index that significant for assessing and constraining the potential of mudstone as source rocks for biogenic gas.
Key words:Qaidam Basin; biogenic gas; biomarkers; biodegradation; gas source rock
基金项目:国家自然科学基金项目(No.41172132)和甘肃省油气资源研究重点实验室专项(1309RTSA041)资助。
文章编号:0253-2697(2016)03-0318-10
DOI:10.7623/syxb201603004
中图分类号:TE121.3
文献标识码:A
(收稿日期:2015-10-12 改回日期2016-02-16 责任编辑 张 怡)
