天山乌鲁木齐河源一号冰川表面粉尘蓝细菌群落结构及其系统发育
【类型】期刊
【作者】倪雪姣,齐兴娥,顾燕玲,郑晓吉,董娟,倪永清,程国栋(石河子大学食品学院;中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室)
【作者单位】石河子大学食品学院;中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室
【刊名】微生物学报
【关键词】 天山;冰尘;蓝细菌;系统发育分析
【资助项】国家自然科学基金项目(40961002,41140009,41271268);冻土工程国家重点实验室开放基金项目(sklfse200903);中国博士后科学基金特别资助(20100339...
【ISSN号】0001-6209
【页码】P1256-1266
【年份】2019
【期号】第11期
【期刊卷】1;|7;|8;|4;|5;|2;|12
【摘要】【目的】揭示天山乌鲁木齐河源一号冰川表面粉尘中蓝细菌多样性、群落结构及其系统发育,为科学评价冰川表面及相关环境中功能微生物的地球化学循环作用提供参考依据。【方法】采用两对蓝细菌16S rRNA基因特异引物扩增并构建克隆文库,基于序列相似性归类OTU并统计多样性,代表OTU序列与NCBI、RDP数据库比对后构建系统发育树。【结果】天山一号冰川表面粉尘101个蓝细菌克隆序列基于97%的相似性被划分为12个OTU,shannon多样性指数为1.522,系统发育分析显示主要隶属于颤蓝细菌目(Oscillatoriales)和色球蓝细菌目(Chroococcales)。Oscillatoriales包括席蓝细菌属(Phormidium)、微鞘蓝细菌属(Microcoleus)、伪鱼腥蓝细菌属(Pseudanabaena)和颤蓝细菌属(Oscillatoria)4个属,其中Phormidium占绝对优势,68个克隆序列划分为4个OTU,其它3个属的序列较少。Chroococcales仅有1个克隆,与亚球形管胞蓝细菌(Chamaesiphon subglobosus)亲缘关系很近。此外,发现一号冰川表面粉尘的速效磷、速效钾含量是冰川退缩前沿50 m-500 m距离土壤的2-5倍,硝态氮达到10-20倍,有机质含量达到3-9倍,显著高于冰川前沿环境。【结论】天山一号冰川表面粉尘蓝细菌的多样性指数相对较高,以隶属于Phormidium属的成员占绝对优势,对其生态学作用需进一步深入探究。
【全文】 文献传递
研究报告
天山乌鲁木齐河源一号冰川表面粉尘蓝细菌群落结构及其系统发育
倪雪姣1,齐兴娥1,顾燕玲1,郑晓吉1,董娟1,倪永清1,2*,程国栋2
1石河子大学食品学院,新疆 石河子 832000
2中国科学院寒区旱区环境与工程研究所,冻土工程国家重点实验室,甘肃 兰州 730000
摘要:【目的】揭示天山乌鲁木齐河源一号冰川表面粉尘中蓝细菌多样性、群落结构及其系统发育,为科学评价冰川表面及相关环境中功能微生物的地球化学循环作用提供参考依据。【方法】采用两对蓝细菌16S rRNA基因特异引物扩增并构建克隆文库,基于序列相似性归类 OTU并统计多样性,代表 OTU序列与NCBI、RDP数据库比对后构建系统发育树。【结果】天山一号冰川表面粉尘101个蓝细菌克隆序列基于97%的相似性被划分为12个OTU,shannon多样性指数为1.522,系统发育分析显示主要隶属于颤蓝细菌目(Oscillatoriales)和色球蓝细菌目(Chroococcales)。Oscillatoriales包括席蓝细菌属(Phormidium)、微鞘蓝细菌属(Microcoleus)、伪鱼腥蓝细菌属(Pseudanabaena)和颤蓝细菌属(Oscillatoria)4个属,其中Phormidium占绝对优势,68个克隆序列划分为4个OTU,其它3个属的序列较少。Chroococcales仅有1个克隆,与亚球形管胞蓝细菌(Chamaesiphon subglobosus)亲缘关系很近。此外,发现一号冰川表面粉尘的速效磷、速效钾含量是冰川退缩前沿50 m-500 m距离土壤的2-5倍,硝态氮达到10-20倍,有机质含量达到3-9倍,显著高于冰川前沿环境。【结论】天山一号冰川表面粉尘蓝细菌的多样性指数相对较高,以隶属于Phormidium属的成员占绝对优势,对其生态学作用需进一步深入探究。
关键词:天山,冰尘,蓝细菌,系统发育分析
地球上的冰川主要分布在南极、北极、格陵兰和世界各地的山地,约占地球陆地总面积的10%。研究发现,由于物理化学特征和气候环境的显著差异,冰川生态系统在空间上具有明显的异质性,形成了明显不同的微生物群落结构。冰川表面、冰芯和周边冻土层及冰川融水中生存着不同的功能微生物类群,这些微生物类群的活动对冰川及周边环境的地球生物化学循环过程有着极其重要的作用[1-2]。此外,相关研究表明,冰川冰芯和表面微生物群落结构具有一定的相似性,可以作为反映区域气候及环境变化的生物指标[3-4]。
蓝细菌(Cyanobacteria)是一类光能自养生物,由于其具有两种独特的光合内膜结构(包括光系统Ⅰ和Ⅱ),能够固定CO2并产生氧气;在硫化物存在时,也能通过光系统Ι进行不产氧的光合作用。此外,许多丝状蓝细菌在缺乏无机氮化合物(如硝酸盐或铵盐)的极端寡营养条件下,能够形成异形胞进行固氮作用[5]。因此,蓝细菌的生态分布极其多样,不仅生存于淡水、海水和土壤中,还能耐受各种不良的极端环境条件,如盐湖[6]、沙漠中极端干旱的岩石[7]、冷泉[8]或高温温泉[9]以及寒冷的极地、山岳冰川表面[10]。
研究表明,大气粉尘向冰川表面输入微生物,来自陆地灰尘、海洋表面气溶胶和火山岩灰烬的外源微生物可以粘附在积雪、矿物质或者有机质颗粒上[11],在冰川表面经过冰川表层融水作用、分选、再聚集,尤其在一些微生物产生大量的胞外多糖的粘附作用下,在冰川表面形成深色的冰尘(cryoconite)或堆状丘(kame)(图1),冰尘吸收太阳辐射向下融进冰川表面形成冰尘洞,这些生境有机质含量丰富,不仅为外源异养微生物提供了栖息生境,也为藻类、蓝细菌等光能微生物的生存繁衍提供了场所。冰川表层环境中微生物处于总生物量的主导地位,其中蓝细菌是最优势的类群[12],它们能够很好的适应于长期冷冻的环境,甚至在温度-20℃时仍具有代谢能力[13]。因此,蓝细菌很可能作为初级生产者为冰川表面贡献碳源和氮源,有利于冰川表面其它微生物的生长和繁殖,在冰川生态体系中发挥重要作用。
天山乌鲁木齐河源一号冰川是我国气象变化、水文径流量、物质平衡等数据最为完备的冰川[14-15]。目前有关天山一号冰川周边冻土、积雪[16]、冰芯细菌多样性的研究已有报道,而对表面冰尘中蓝细菌群落组成及系统发育的研究报道很少。本研究采用克隆文库法对一号冰川粉尘中蓝细菌群落结构多样性及系统发育进行了分析,为科学评价天山乌鲁木齐河源地区冰川表面及相关环境微生物在地球化学循环过程中的作用,以及作为一个生物指标为区域气候、环境变化趋势的预测提供理论参考依据。
1 材料和方法
1.1 材料
1.1.1 样品采集和处理:样品于2012年10月5日采集自天山一号冰川(43°06'N,86°49'E)表面,海拔3740-4480米,在冰川表层设置3个取样点(图1中A、B、C),每个样点2 m×2 m,平行取样5份。将粉尘颗粒迅速装入己灭菌的保鲜盒内,置于车载冰箱中,12 h之内运回实验室,部分样品保存在-70℃超低温冰箱;用于构建克隆文库的样品暂放-20℃保存,取部分样品进行理化性质测定。以上所有过程均在无菌条件下完成。
1.1.2 主要试剂和仪器:大肠杆菌(Escherichia coli)DH5α;DNA提取试剂盒(Mo Bio Laboratories,Carlsbad,CA)、PCR产物纯化试剂盒(Qiagen,Hilden,Germany)均购自QIAGEN公司;TA克隆载体pGEM-T、PCR扩增的全套试剂及扩增引物均购自TaKaRa公司;其余试剂均为进口或国产分析纯; DNA分子量Marker购自天根生化科技(北京)有限公司。高速冷冻离心机为Thermo公司Fresco21型; PCR仪为德国Biometra公司Tprofessional;凝胶成像系统为BioRad公司GelDOC XR;水平电泳仪为美国BioRad公司 PowerPac Universal、电泳槽 SUBCELL GT(20×25 cm)。
1.1.3 培养基:用于构建克隆文库的培养基主要为SOB培养基(g/L)(酵母提取物5 g,胰蛋白胨20 g,NaCl 0.58 g,KCl 0.186 g,100×Mg2+溶液10 mL,溶解于800 mL去离子水中并定容至1 L,121℃高压蒸汽灭菌20 min)。所用抗生素为氨苄青霉素钠盐(100mg/mL),X-Gal及 IPTG试剂浓度分别为 20 mg/mL、24 mg/mL。
1.2 样品理化性质测定
对粉尘pH值(水∶粉尘=2.5∶1)、速效磷、速效钾、硝态氮、总有机质及总碳、总氮的测定参照文献[17-18]进行,每个样品测3个平行。统计与分析采用spss18.0进行。
1.3 样品总DNA提取及其纯化
采用直接法结合商业试剂盒提取样品总DNA。直接法参照 zhou等[19]DNA提取法提取,略有改动。5 g粉尘样品中加入DNA裂解液、蛋白酶K及溶菌酶后,37℃ 200 r/min水平震荡30 min;65℃水浴2 h后加入20%SDS溶液,超低温冰箱冻融3次后在水平击打器上击打10 min;用苯酚、氯仿、异戊醇(25∶24∶1)离心抽提 DNA,3M异丙醇过夜沉淀DNA;70%预冷酒精洗涤2次,最后溶解于100 μL的TE溶液。同时采用PowerSoilTMDNA Isolation Kit(Mo Bio Laboratories,Carlsbad,CA)试剂盒提取DNA,用Wizard®DNA Clean-Up System试剂盒纯化提取的总DNA。每个样点提取5份,混合后用于文库构建。提取DNA 4℃保存,采用分光光度计对核酸浓度和纯度进行定量。
1.4 蓝细菌16S rRNA基因PCR扩增
采用两对蓝细菌特异性引物,对混合后的3份DNA样品分别进行3个平行实验扩增蓝细菌16S rRNA部分基因。第一对引物为 CYA359F和CYA781R(表 1),扩增体系:10×Taq PCR Master mix 12.5 μL,引物各0.5 μL(20 μmoL/mL),DNA模板0.3 μL,加灭菌 ddH2O至25 μL。热循环参数:94℃预变性5 min,94℃变性1 min,52℃复性1 min,72℃延伸1 min,30个循环,最后72℃延伸7 min。第二对引物为CYA-b-371F和CYA783R,采用巢式PCR:第一轮扩增先用27F、1492R细菌通用引物,反应体系及其它条件同上,退火温度为55℃;第二轮扩增用引物CYA-b-371F、CYA783R,扩增体系:10×Taq PCR Master mix 12.5 μL,引物各0.5 μL (20 μmoL/mL),DNA模板为第一次 PCR产物0.5 μL,加灭菌ddH2O至25 μL。热循环参数:94℃5 min;94℃ 1 min,60℃ 1 min,72℃ 1 min,35个循环;72℃ 10 min。PCR产物均用1.5%的琼脂糖凝胶电泳检测。
表1 .用于扩增蓝细菌16S rRNA基因的特异性引物
Table1 .The special primers used to amplify Cyanobacteria 16S rRNA gene
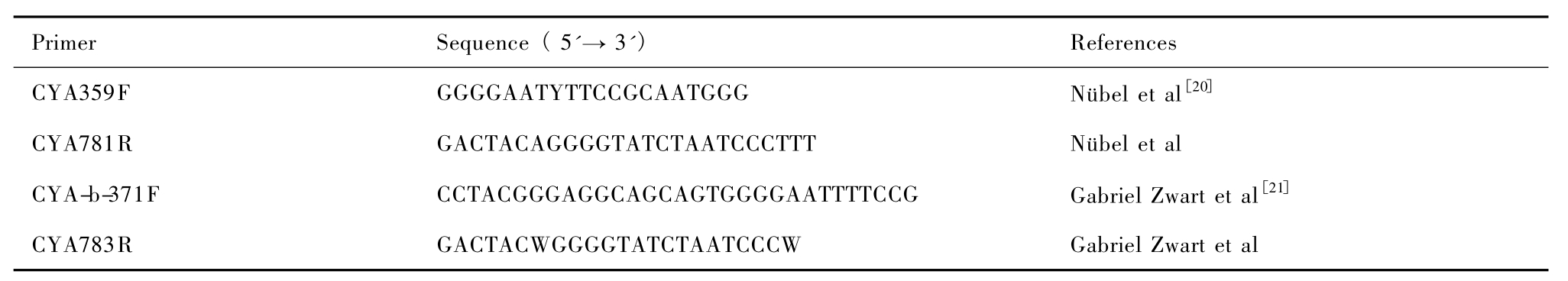
Primer Sequence(5'→3') References CYA359F GGGGAATYTTCCGCAATGGG Nübel et al[20]CYA781R GACTACAGGGGTATCTAATCCCTTT Nübel et al CYA-b-371F CCTACGGGAGGCAGCAGTGGGGAATTTTCCG Gabriel Zwart et al[21]CYA783R GACTACWGGGGTATCTAATCCCW Gabriel Zwart et al
1.5 PCR产物纯化和16S rRNA基因文库的构建
将每对引物扩增后的 PCR产物混合后,用QIAquick PCR purification kit(Qiagen,Hilden,Germany)纯化试剂盒纯化。根据厂商提供的说明书,用pGEM-T Vector(Promega)载体对纯化的2对PCR产物分别进行克隆。挑取白色单菌落,用载体引物T7和 SP6对克隆子进行PCR扩增鉴定,筛选片段大小正确的克隆子进行测序。(第一对引物PCR产物大小约为450 bp,第二对引物PCR产物大小约为400 bp)。
1.6 数据统计分析
110个克隆子由上海美吉生物科技有限公司在ABI377DNA自动测序仪上采用 ABI PRISM BigDye terminator v3.1 sequencing Ready Reaction kit(PE Applied Biosystems)直接测序。将所得的16S rRNA基因序列采用 BioEdit 7.0.5软件(http://www. mbio.ncsu.edu/BioEdit/bioedit.ht)手动校正,统一序列方向和长度,制作产生FASTA格式的文件,采用Ribosomal Database Project(RDP)II数据库的CHIMERA_CHECK program(http://rdp.cme.msu. edu/seqmatch/seqmatch_intro.jsp)检测嵌合体序列,在后续分析中予以剔除。用 CLUSTALX1.83软件进行序列联配,用 PHYLIP-3.68软件和 DOTUR-1.53软件以 97%的相似度 cutoff水平上,采用furthest-neighbor method归 类和确定 OTU (或Phylotypes),并计算 Shannon和 Simpson多样性指数,以及Nonparametric richness estimates(包括chao1和ACE指数)。同时采用EstimateS Win 8.00软件进行文库的稀有度曲线分析,根据公式C=(1-n· N-1)·100,(N为文库总克隆数,n代表在文库中仅出现一次的OTU数量)计算克隆文库的Coverage。
1.7 构建系统发育树
将隶属于每个 OTU的代表序列在 NCBI的BLAST 以 及 RDP’sNaïve Bayesian Classifier (confidence threshold,80%)中进行最相近序列匹配的分类归属,并提交到 GenBank基因库中。每个OTU代表克隆序列与来自 GenBank、RDP II数据库中的亲缘关系较近的 16S rRNA基因序列采用CLUSTAL x 1.83软件进行联配,进化距离的计算采用邻接法 neighbor-joining method,在 MEGA v.5.1软件中用p-distances法和Kimura-2parameter双参数法构建进化树,通过bootstrap法评价进化树分支聚类的稳定性,重复次数为1000。
2 结果
2.1 乌鲁木齐河源一号冰川表面粉尘的理化性质
分析结果表明,乌鲁木齐河源天山一号冰川表面粉尘颗粒粒径约为0.34 mm-3.35 mm,分布相对均一,没形成明显的堆状丘(图1),pH约为7.0。粉尘中速效磷、速效钾、硝态氮、有机质以及总氮指标显著高于冰川前沿环境土壤(p<0.01)(表2)。其中一号冰川表面粉尘的速效磷、速效钾含量是冰川退缩前沿50 m-500 m距离土壤的2-5倍,硝态氮含量达到10-20倍,有机质含量达到4-9倍,均显著高于冰川前沿环境。一号冰川表面粉尘的硝态氮、有机质以及总氮含量甚至显著高于距离冰川末端1000 m发育成熟的高山草甸表层土,分别是3-5倍。只有总磷含量与冰川前沿环境相近。

图1 .天山一号冰川表面粉尘采样点分布
Figure 1.Photographs of the sampling sites on the surface of the Glacier No.1 in the Tianshan Mountains.Marked A,B and C represented the different sample sites A,B and C,respectively.
表2 .天山乌鲁木齐河源一号冰川表面粉尘的理化特性
Table 2 .Physicochemical properties of supraglacial cryoconite from the Glacier No.1 in the Tianshan Mountains
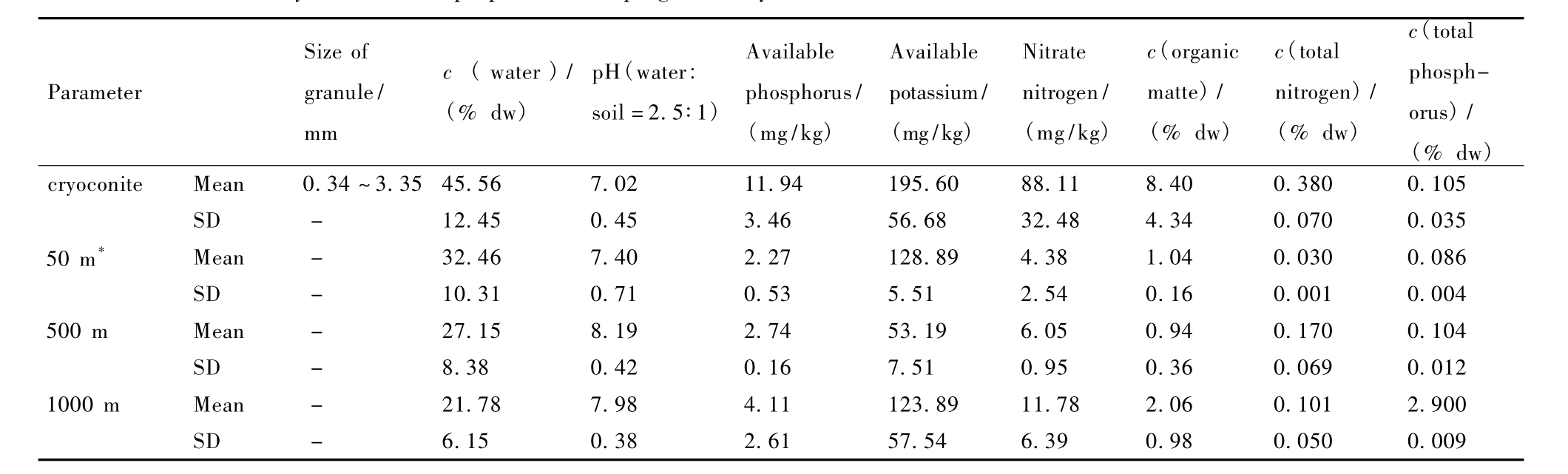
SD:standard deviation.analysised by SPSS 18.0 date editor;* represent the distance from the glacier forefield.
c(total phosphorus)/ (%dw) cryoconite Mean 0.34~3.35 45.56 7.02 11.94 195.60 88.11 8.40 0.380 0.105 SD - 12.45 0.45 3.46 56.68 32.48 4.34 0.070 0.035 50 m*Mean - 32.46 7.40 2.27 128.89 4.38 1.04 0.030 0.086 SD - 10.31 0.71 0.53 5.51 2.54 0.16 0.001 0.004 500 m Mean - 27.15 8.19 2.74 53.19 6.05 0.94 0.170 0.104 SD - 8.38 0.42 0.16 7.51 0.95 0.36 0.069 0.012 1000 m Mean - 21.78 7.98 4.11 123.89 11.78 2.06 0.101 2.900 Parameter Size of granule/ mm c(water)/ (%dw) pH(water: soil=2.5∶1) Available phosphorus/ (mg/kg) Available potassium/ (mg/kg) Nitrate nitrogen/ (mg/kg) c(organic matte)/ (%dw) c(total nitrogen)/ (%dw) SD - 6.15 0.38 2.61 57.54 6.39 0.98 0.050 0.009
2.2 天山一号冰川粉尘蓝细菌的多样性及群落结构
从用两种引物构建的蓝细菌16S rRNA文库中,各挑选了55个阳性克隆子进行测序,排除嵌合体序列以及测序质量较差的序列后,得到的101条序列联配构建距离矩阵,用 DOTUR-1.53软件在97%相似性标准进行 OTU的划分,共得到 12个OTU,其中4个OTU仅含有1个克隆。多样性指数统计结果显示,shannon、simpson指数分别为1.522、 0.346。图2为稀有度曲线,当克隆子数大于100时,曲线已渐渐趋于平缓,其覆盖率 C达到96.04%,表明构建文库测序数目基本达到饱和,101个克隆子基本能够涵盖天山一号冰川粉尘中绝大部分蓝细菌群落,也能够代表冰川表面粉尘的蓝细菌多样性。
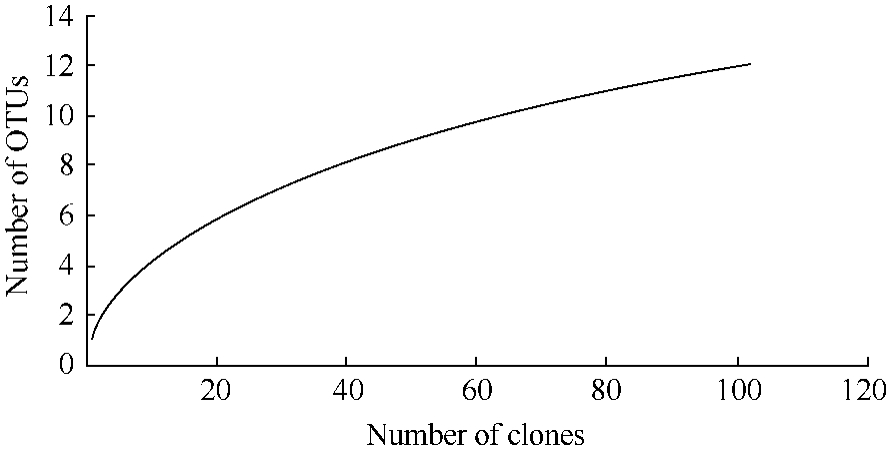
图2 .天山一号冰川粉尘蓝细菌克隆文库稀有度曲线
Figure 2.Rarefaction curve constructed for Cyanobacterial clone library from supraglacial cryoconite of the Glacier No.1 in the Tianshan Mountains.
利用BLAST搜索最相近序列,根据最相近序列隶属的分类学归属,在目和属水平上统计蓝细菌群落结构。分析显示,天山一号冰川粉尘16S rRNA基因文库序列代表的蓝细菌主要隶属于2个系统发育类群,包括 Oscillatoriales(81%)和 Chroococcales (1%)。此外,总文库序列中还有无法确定分类学地位的蓝细菌(unclassified cyanobacterium)和不能确定细菌门的序列(unclassified bacterium),分别占17%和1%(如图3)文库中只有一个克隆子属于Chroococcales;而属于 Oscillatoriales的序列较为多样,共包括4个属,其中隶属于Phormidium的克隆子68个,占Oscillatoriales克隆数的67%,是绝对优势种 群,隶 属 于 Microcoleus、Pseudanabaena和Oscillatoria的克隆子分别占该目总数的2%、5%和7%(图3)。
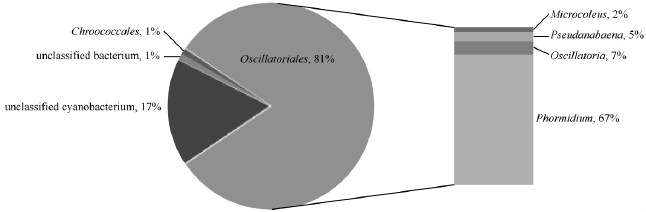
图3 .天山一号冰川微尘蓝细菌16S rRNA基因文库群落结构组成
Figure 3.Distribution of cyanobacterial phylogenetic groups from supraglacial cryoconite of the Glacier No.1 in the Tianshan Mountains.
2.3 天山一号冰川粉尘蓝细菌的系统发育
蓝细菌16S rRNA基因文库获得的101个克隆子序列以97%的相似性标准被划分为12个OTU,用每个OTU的代表序列以及数据库的相近序列构建系统发育树(图4)。其中以OTU1、OTU2、OTU3和OTU4为代表的68个克隆子均属于Phormidium属,归属于 OTU1的55个克隆子与分离自南极的Phormidium sp.Ant-Orange类群相似度达到了99%,归于OTU2的2个克隆子分别与溪流微生物菌垫的 免 培 养 Phormidium sp.序 列 和 南极Phormidium autumnale JR2序列的相似度都达到了99%,OTU3的9个克隆子分别与分离自南极 Dry Valleys的 Phormidium priestleyi ANT.LG2.4序列和北极 AustreLovénbreen冰 川 表 面 免 培 养 的Phormidium priestleyi ANT.L66.1亲缘关系很近,相似度均达到了99%,OTU4的2个克隆子与分离自南极的 Phormidium sp.CYN64序列和 Phormidium sp.PMC301.07序列具有 98%、99%的相似性。OTU5属于蓝细菌Microcoleus属,其2个克隆子与来自于极地的Microcoleus antarcticus UTCC 474序列相似度达到了97%,在发育树上这个属的克隆子与Phormidium亲缘关系很近。有研究报道,蓝细菌Phormidium和Microcoleus的分类地位并不明确[22],需要更精确的方法(如功能酶基因序列等)进一步明确区分两个属的类群。OTU6和OTU7属于蓝细菌Pseudanabaena,其中OTU6的4个克隆子分别与分离自北极的 Pseudanabaena sp.lw0831和分离自地下淡水的Pseudanabaena sp.CAWBG531序列相似度达到了99%和98%。OTU7只有1个克隆子,与 Pseudanabaenaceae cyanobacterium HTJ2-KK1的16S rRNA基因序列最相近,但相似性只有 93%。OTU8的7个克隆子属于Oscillatoria,与分离自南极Barton半岛、King George Island及 South Shetland Islands融水中的Oscillatoria sp.KNUA009的序列相似性达到96%[23]。OTU9属于蓝细菌 Chroococcales目,与分离自南极的 Chroococcales cyanobacterium CYN67的序列相似性达到 98%,另外与Chamaesiphon subglobosus序列相似性达到了97%,大量研究表明,在挪威的 Svalbard冰川表面[17]以及南极洲Dry Valley生态系统[24]、珠穆拉玛峰冰川积雪中生存着许多 Chroococcales的类群,但这个目的类群在天山一号冰川表面粉尘中很少。OTU10和 OTU11的克隆子属于蓝细菌中的未知菌群,17个克隆子分别与南极未知蓝细菌 (uncultured cyanobacterium)和McMurdo冰架盐融水池塘免培养的蓝细菌(uncultured Antarctic cyanobacterium)序列相似度达到了99%和92%。OTU12仅有1个克隆子,属于未知分类地位的细菌,与数据库中最相似序列(uncultured bacterium)的相似性只有93%。
表3 .天山乌鲁木齐河源一号冰川粉尘蓝细菌16S rRNA基因克隆文库归类OTU的系统发育
Table 3 .Taxonomic affiliations of representative clones from OTUs for the clone libraries of supraglacial cryoconite of the Glacier No.1 in the Tianshan Mountains,determined by phylogenetic analysis of 16S rRNA gene sequences
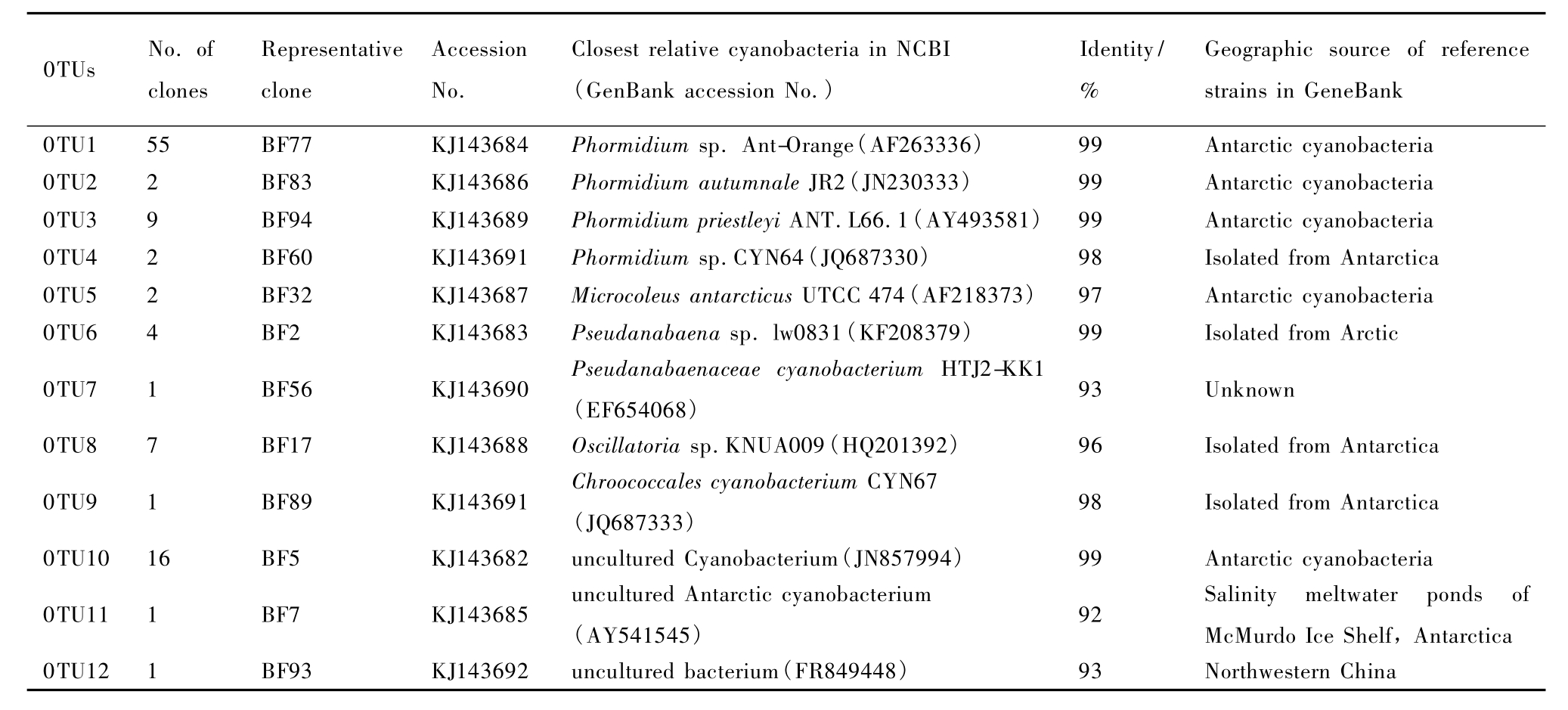
0TUs No.of clones Geographic source of reference strains in GeneBank 0TU1 55 BF77 KJ143684 Phormidium sp.Ant-Orange(AF263336) 99 Antarctic cyanobacteria 0TU2 2 BF83 KJ143686 Phormidium autumnale JR2(JN230333) 99 Antarctic cyanobacteria 0TU3 9 BF94 KJ143689 Phormidium priestleyi ANT.L66.1(AY493581) 99 Antarctic cyanobacteria 0TU4 2 BF60 KJ143691 Phormidium sp.CYN64(JQ687330) 98 Isolated from Antarctica 0TU5 2 BF32 KJ143687 Microcoleus antarcticus UTCC 474(AF218373) 97 Antarctic cyanobacteria 0TU6 4 BF2 KJ143683 Pseudanabaena sp.lw0831(KF208379) 99 Isolated from Arctic 0TU7 1 BF56 KJ143690 Pseudanabaenaceae cyanobacterium HTJ2-KK1 (EF654068) 93 Unknown 0TU8 7 BF17 KJ143688 Oscillatoria sp.KNUA009(HQ201392) 96 Isolated from Antarctica 0TU9 1 BF89 KJ143691 Chroococcales cyanobacterium CYN67 (JQ687333) 98 Isolated from Antarctica 0TU10 16 BF5 KJ143682 uncultured Cyanobacterium(JN857994) 99 Antarctic cyanobacteria 0TU11 1 BF7 KJ143685 uncultured Antarctic cyanobacterium Representative clone Accession No. Closest relative cyanobacteria in NCBI (GenBank accession No.) Identity/ % (AY541545) 92 Salinity meltwater ponds of McMurdo Ice Shelf,Antarctica 0TU12 1 BF93 KJ143692 uncultured bacterium(FR849448)93 Northwestern China
3 讨论
采用免培养的分子生物学方法研究极端环境微生物的多样性及群落结构、功能,近些年来已成为国内外研究的热点问题。对于极端温度环境(如冰冻圈、高温热泉、戈壁干旱区)的蓝细菌种群及其生态功能也受到很多关注。本研究通过构建天山乌鲁木齐河源一号冰川表面粉尘蓝细菌16S rRNA基因克隆文库,群落结构及系统发育分析结果显示97%的序列归属于蓝细菌,大多数的序列属于蓝细菌门的Oscillatoriales和 Chroococcales 2 个 目。其 中Oscillatoriales占绝对优势,这一结果与北极挪威Svalbard冰川表面粉尘中通过形态观察和分离得到的结果相一致[17]。在南、北极的淡水和陆地生态系统中丝状的 Oscillatoriales类群也居优势地位,常见的属 包 括 瘦 鞘 丝 蓝 细 菌 属 (Leptolyngbya)、Oscillatoria和Phormidium[25-26]。这3个属均为无异形胞的丝状固氮蓝细菌,被认为是构成藻类生物结皮的主要类群。Katia Comte等[22]在南极 peninsula和 South Shetland Islands以及北极的 Ellesmere Island也分离到了大量的 Phormidium属菌株,通过形态特征将这些菌株划分为三类,第一类是 Ph.autumnale,第二类是 Phormidium sp,第三类是 Ph.merrayi。前两类在南极陆地生态系统中广泛分布,第三类Ph.merrayi更常见于南极水生生态系统中。依据系统发育分析相似性(相似度在97%-100%之间),我们在一号冰川表面粉尘蓝细菌文库中检测的OTU1和OTU2序列应该属于第一类,OTU4属于第二类。此外,我们还检测到了与分布于南极Dry Valleys的Phormidium priestleyi菌株亲缘关系很近的种群(OTU3)。研究表明,Phormidium属的种群能够耐受各种环境压力,例如,频繁的冷冻、持久的干燥、寡营养及长期无光照等,尤其这些种群很容易形成菌垫,以更有利于其生存繁殖。对于冰川表面季节性及昼夜温度、干湿度波动频繁而言,这些种群具有极强的适应能力,因此成为冰川表面生境的优势种群。
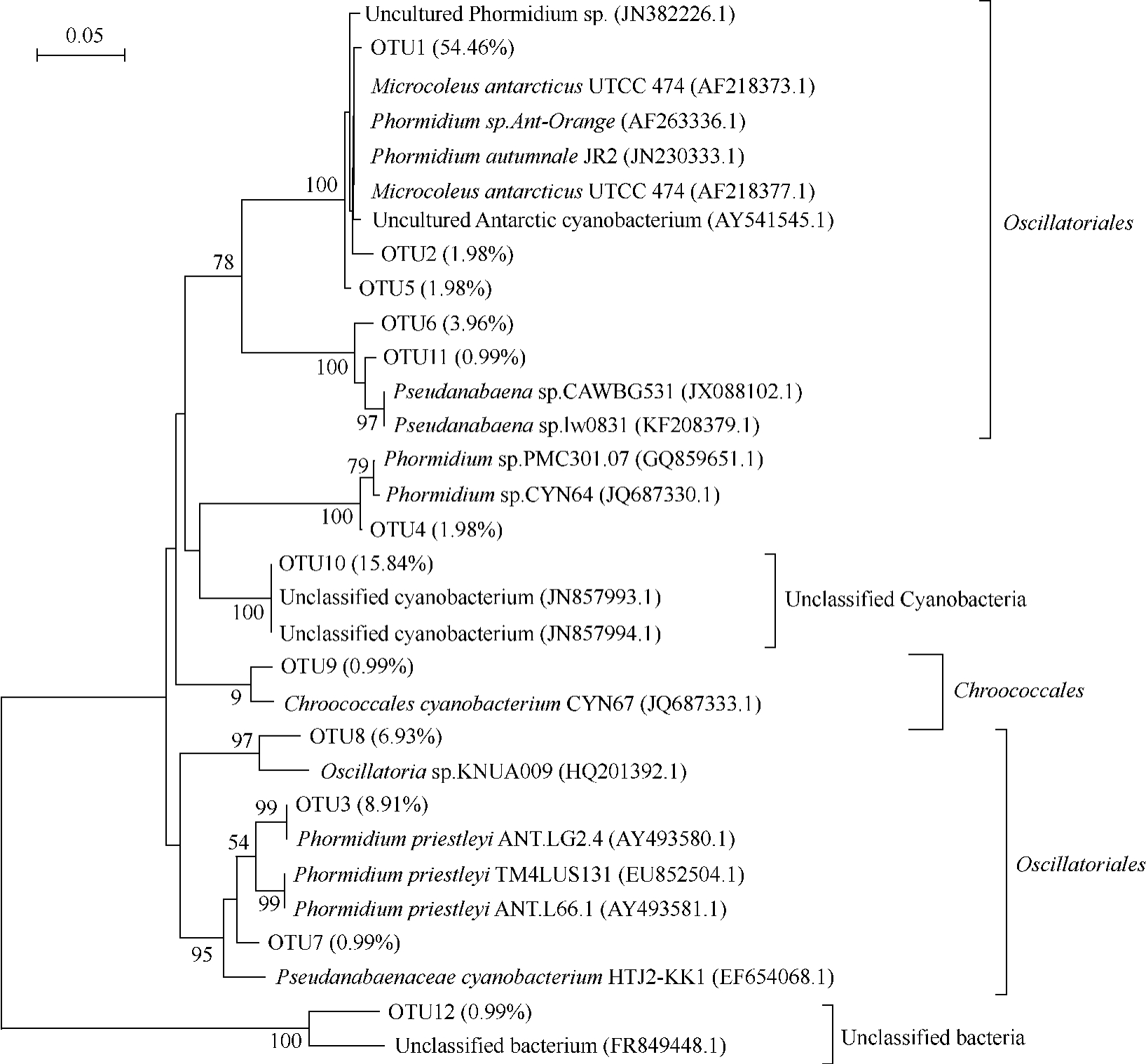
图4 .Neighbor-joining法构建的1号冰川粉尘蓝细菌16S rRNA基因部分序列系统发育树
Figure 4.Neighbour-joining tree showing the phylogenetic relationships among cyanobacteria 16S rRNA gene clones from the Glacier No.1 in the Tianshan Mountains and their closely related sequences downloaded from GenBank.Numbers at the nodes indicate the bootstrap values(50%)based on neighbour-joining analyses of 1000 resampled datasets.Bar:5% sequence divergence.
本研究还检测到了属于 Oscillatoriales目的Microcoleus、Pseudanabaena、Oscillatoria属的克隆子,这些属的类群通常在淡水[27-28],咸水[22]、热泉[9]中均有分布。研究表明,丝状 Pseudanabaena和Microcoleus的类群常能形成水华现象,引起严重的环境问题,但这些菌株能进行光合自养,甚至在无氧的情况下能合成固氮酶,固定大气中 N2,在冰川表面的存在可以为系统中氮源的累积发挥重要作用。此外,部分Microcoleus的种群也是荒漠干旱地区结皮的优势种群,是荒漠植被演替过程中的先锋类群,在土壤形成过程中起重要作用[29]。因此,推测它们在天山一号冰川退缩裸露后生境的土壤成熟过程中可能发挥作用,分布于冰川表面的种群很可能来其前沿生境。Oscillatoria属的种群目前发现主要分布在淡水中,某些菌株在水体表面形成草席状漂浮、滑动,经常栖息在存在亚硫酸盐的环境,在厌氧的含硫环境中发挥关键生态作用[5]。
目前已经有证据表明,冰川底部不仅有产甲烷古菌活动,而且有硝化、反硝化细菌以及异养菌等生存[30],Stibal等[18]认为这些微生物生存所需要的碳源和氮源主要来自冰川表面环境。蓝细菌作为主要的光合自养菌,通过光合作用为其它微生物提供碳源,有些能固氮的蓝细菌还能提供氮源,如文库中发现的 Microcoleus、Pseudanabaena、Oscillatoria种群。这些自养菌的生存不仅促进了部分异养细菌、真菌、藻类和其它耐冷原生动物在冰川表面的定植[31],而且由于冰川表面的积雪、冰层的溶解,使部分融水通过冰川表面形成的锅穴和裂隙到达冰川底部,再加上冰川本身的运动造成冰面与底部沉积层养分的交换,对于冰川底部微生物的碳、氮养分的需求可能起着重要作用。有研究认为,通过无机自养过程蓝细菌生物总量并不能供给冰川表面充足的养分,冰川表面相对充足的养分大部分来自外源空气中颗粒的沉降积累作用[18],尤其冰尘中较高的硝态氮的来源问题目前仍未得到统一结论。我们的分析也显示天山一号冰川表面粉尘相对冰川退缩前沿含有极高的硝态氮(表2)。相反,尽管有机质、总氮等养分显著高于冰川前沿环境,但天山一号冰川表面粉尘的全磷与退缩冰川前沿原始环境非常接近(约为0.1%),这意味着对此前的一个研究报道结果的肯定,即除了温度之外,冰川表面可利用磷的总量是限制其微生物生物量的关键因子[32]。因此,对冰川粉尘及冰尘穴中蓝细菌的生态学作用需要进一步深入开展相关研究工作阐明。
微生物的分布与栖息地的非生物因素有密切的关系,即环境对微生物种群的分布具有选择作用。Stibal等人在北极Svalbard冰川[17]表面微尘中观察并分离到蓝细菌Chroococcales、Oscillatoriales、念珠蓝细菌目(Nostocales)种群,在北极 Austre Lovénbreen冰川 表 面 也 检 测 到 了 Oscillatoriales种 群[27]。Mueller[33]在加拿大北极圈的 White冰川表面的冰尘穴中分离到的蓝细菌也同样包括 Oscillatoriales、Chroococcales、Nostocales种 群。同 时,Porazinska等[34]在南极的 McMurdo Dry Valley冰尘穴中也发现了 Oscillatoriales、Chroococcales种群,以上研究均显示这些蓝细菌属的成员对低温环境有极好的适应性。我们的研究也显示,天山一号冰川表面粉尘蓝细菌文库代表序列大多与来自南北极等低温环境中的培养物及克隆序列亲缘关系最近。但是,研究也发现这些蓝细菌属的一些成员在其它极端生境中也广泛生存,如冰川周围的沙漠[26]、高山白云石孔隙[35]、叠层石上[36]、咸水湖[28]和高温热泉[9]以及一些溪流[25]和浅水湖泊[21]。说明在属水平上这些蓝细菌的生态分布非常广泛、多样,具有极强的生存能力和定植能力。我们认为,基于16S rRNA基因免培养的多样性研究方法本身的缺陷以及缺乏对这些种群的广泛分离培养,目前仍然不能肯定这些蓝细菌种群的地理分布具有冰冻圈生境特异性,即低温生境分布的蓝细菌种群具有特殊的基因型、生态型及相对应的表型。
天山一号冰川表面粉尘颗粒大小、水份含量和理化因子相近,且质地均一没有明显的堆积物(图1),虽然研究发现的蓝细菌仅隶属于 Chroococcales和Oscillatoriales两个目,但检测到的OTU数及多样性指数仍相对高于其它生境,其原因可能与前期研究报道冰川粉尘及冰尘穴细菌多样性均采用有限的可培养方法及低通量的细菌16S rRNA基因文库法有关(文库较小,仅检测到较少的蓝细菌克隆)[17,27,32]。此外,天山一号冰川上空的大气环流、降雨量、降雪覆盖的时间、风向都会影响表面粉尘颗粒的数量及物理化学条件。已经有研究表明,乌鲁木齐河源冰川表面粉尘在5、6月份由于沙尘活动颗粒浓度升高,7、8月份由于季节性大气环境的变化及降水的作用,表面粉尘被洗刷其颗粒的矿物含量会发生变化[37],这些因素也可能会影响蓝细菌的群落结构及多样性。因此有必要针对季节变化取样,进一步阐明蓝细菌群落结构的时间演替规律,对阐明冰川生态系统的生物地球化学循环具有重要意义。
参考文献:
[1]Lotta H.Microbial processes in glaciers and permafrost. Microbial analytics Sweden AB.SKB Rapport R-09-37,2009.
[2]Sharp M,Parkes J,Cragg B,Fairchild IJ,Lamb H,Tranter M.Widespread bacterial populations at glacier beds and their relationship to rock weathering and carbon cycling.Geology,1999,27(2):107-110.
[3]Xiang S,Yao T,An L,Wu G,Xu B,Ma X,Li Z,Wang J,Yu W.The number of the culturable bacteria and the main microorganisms of the Musitage ice core vary with the depth of the ice core.Science in China,2005,35(3):252-262.(in Chinese)向述荣,姚檀栋,安黎哲,邬光剑,徐柏青,马晓军,李真,汪君霞,余武生.慕士塔格冰芯可培养细菌的数量分布和主要菌群结构随深度的变化.中国科学,2005,35(3):252-262.
[4]Abyzov SS,Mitskevich IN,Poglazova MN.Microflore of the deep glacier horizons of central Antarctica. Microbiology(Moscow),1998,67:66-73.
[5]陶天申,杨瑞馥,东秀珠,原核生物系统学.北京化学工业出版社,2007:216-217.
[6]Acinas SG ,Haverkamp THA ,Huisman J,Stal LJ. Phenotypic and genetic diversification of Pseudanabaena spp.(cyanobacteria).International Society for Microbial Ecology,2009,3:31-46.
[7]Zhao J,Zhang B,Zhang Y.Study on chlorophy of microbiotic crusts in the Gurbantonggut desert,Xinjiang. Arid ZoneResearch,2005,23(2):189-194. (in Chinese)赵建成,张丙昌,张元明.新疆古尔班通古特沙漠生物结皮绿藻研究.干旱区研究,2005,23(2):189-194.
[8]Henneberger R,Moissl C,Amann T,Rudolph C,Huber R.New insights into the lifestyle of the cold-loving SM1 Euryarchaeon:natural growth as a monospecies biofilm in the subsurface.Applied and Environmental Microbiology,2006,72(1):192-199.
[9]Ionescu D, Hindiyeh M, MalkawiH, Oren A. Biogeography of thermophilic cyanobacteria:insights from the Zerka Máin hot springs(Jordan). Federation of European Microbiological Societies,2010,72(1):103-113.
[10]Whitton BA,Potts M.The Ecology of Cyanobacteria:their diversity in time and space.London:Kluwer Academic Publishers,2000.
[11]Margesin R, Miteva V. Diversity and ecology of psychrophilic microorganisms.Research in Microbiology,2010,162(3):346-361.
[12]Vincent WF.Evolutionary origins of Antarctic microbiota: invasion,selection and endemism. AntarcticScience,2000,12(3):374-385.
[13]Vincent WF,Mueller DR,Bonilla S.Ecosystems on ice: the microbial ecology of Markham ice shelf in the high arctic.Cryobiology,2004,48:103-112.
[14]Sun M,Li Z,Yao X,Zhang M.Analysis on runoff variation of Glacier No.1 at the headwaters of the Urumqi river from 1959 to 2008.Journal of Natural Resources,2012,27(4):650-660.(in Chinese)孙美平,李忠勤,姚晓军,张明军.1959-2008年乌鲁木齐河源1号冰川融水径流变化及其原因.自然资源学报,2012,27(4):650-660.
[15]Li Z,Shen Y,Wang F,Li H,Dong Z,Wnag W,Wang L.Response of glacier melting to climate change-take UrumqiGlacierNO.1 asan example. Journalof Glaciology and Geocryology.2007,29(3):333-342.(in Chinese)李忠勤,沈永平,王飞腾,李慧林,董志文,王文彬,王林.冰川消融对气候的影响-以乌鲁木齐河源1号冰川为例.冰川冻土,2007,29(3):333-342.
[16]Liu YQ,Yao TD,Jiao NZ,Tian LD,Hu AY,Yu WS,Li SH.Microbial diversity in the snow,a moraine lake and a stream in Himalayan glacier.Extremophiles,2011,15 (3):411-421.
[17]Stibal M, Sabacká M, Kastovská K. Microbial communities on glacier surfaces in Svalbard:impact of physicaland chemicalproperties on abundance and structure of cyanobacteria and algae.Microbial Ecology,2006,52:644-654.
[18]Stibal M,Tranter M,Benning LG,Rˇehák J.Microbial primary production on an Arctic glacier is insignificant in comparison with allochthonous organic carbon input. Environmental Microbiology,2008,10(8):2172-2178.
[19]Zhou J,Bruns MA,Tiedje JM.DNA recovery from soils of diverse composition. Applied and Environmental Microbiology,1996,62:316-322.
[20]Nübel U,Ferran GP,Muyzer G.PCR primers to amplify 16S rRNA genes from cyanobacteria. Applied and Environmental Microbiology,1997,63(8):3327-3332
[21]Zwart G,Agterveld MK,Werff-Staverman I,Hagen F,Hoogveld HL,Gons HJ.Molecular characterization of cyanobacterial diversity in a shallow eutrophic lake. Environmental Microbiology,2005,7(3):365-377.
[22]ComteK,Sabacká M,Carré-MloukaA,ElsterJ,Komárek J.Relationships between the Arctic and the Antarctic cyanobacteria;three Phormidium-like strains evaluated by a polyphasic approach. Federation of European Microbiological Societies,2007,59:366-376.
[23]Hong JW,Kim SH,Choi HG,Kang SH,Yoon HS. Isolation and description of a globally distributed cryosphere cyanobacterium from Antarctica. Polar Research,2013,32,http://dx.doi.org/10.3402/polar. v32i0.18529.
[24]Wood SA,Rueckert A,Cowan DA,Cary C.Sources of edaphic cyanobacterial diversity in the dry valleys of eastern Antarctica. InternationalSocietyforMicrobial Ecology,2008,2:308-320.
[25]Elster J,Svoboda J,Komárek J,Marvan P.Algal and cyanoprocaryote communities in a glacial stream,Sverdrup pass 79°N,central Ellesmere Island,Canada.Archiv Fur Hydrobiologie,1997,85:57-93.
[26]Elster J,Lukešová A,Svoboda J,Kopecky',Kanda H. Diversity and abundance of soil algae in the polar desert,Sverdrup pass,central Ellesmere Island.Polar Recearch,1999,35:231-254.
[27]Zeng YX,Yan M,Yu Y,Li HR,He JF,Sun K,Zhang F. Diversity of bacteria in surface ice of Austre Lovénbreen glacier,Svalbard.Archives of Microbiology,2013,195(5):313-322.
[28]Jungblut AD,Hawes I,Mountfort D,Hitzfeld B,Dietrich DR, Burns BP, Neilan BA. Diversity within cyanobacterial mat communities in variable salinity meltwaterponds ofMcMurdo ice shelf, Antarctica. Environmental Microbiology,2005,7(4):519-529.
[29]Zheng Y,Zhang B,Zhao J,Xu M.The contribution of microcoleus vaginatus to the formation of algal crust in the arid desert.Acta Ecologica Sinica,2010,30(6):1655-1664.(in Chinese)郑云普,张丙昌,赵建成,徐明.具鞘微鞘蓝细菌在荒漠藻结皮形成过程中的作用.生态学报,2010,30(6): 1655-1664.
[30]Boyd ES,Lange RK,Mitchell AC,Havig JR,Hamilton TL,Lafrenière MJ,Shock EL,Peters JW,Skidmore M. Diversity,abundance,and potential activity of nitrifying and nitrate-reducing microbial assemblages in a subglacial ecosystem. Applied and EnvironmentalMicrobiology, 2011,77(14):4778-4787.
[31]Zhang W,Zhang G,Liu G,Li T,Li Z,An L.Diversity and its temporal-spatialcharacteristics of eukaryotic microorganisms on Glacier No.1 at the Ürümqi river head,Tianshan Montains. Journal of Glaciology and Geocryology,2010,32(5):906-913.(in Chinese)张威,章高森,刘光琇,李田,李忠勤,安黎哲.天山乌鲁木齐河源1号冰川中真核微生物多样性分布及时空变化研究.冰川冻土,2010,32(5):906-913.
[32]Hodson A,Anesio AM,Tranter M,Fountain A,Osborn M,Priscu J,Laybourn-Parry J,SattlerB. Glacial Ecosystems.Ecological Monographs,2008,78(1):41-67.
[33]Mueller DR,Pollard WH.Gradient analysis of cryoconite ecosystems from two polar glaciers.Polar Biology,2004,27:66-74.
[34]Porazinska DL,Fountain AG,Nylen TH,Tranter M,Virginia RA, Wall DH. The biodiversity and biogeochemistry of cryoconite holes from McMurdo Dry Valley glaciers,Antarctica.Arctic,Antarctic and Alpine Research,2004,36(1):84-91.
[35]Sigler WV, Bachofen R, Zeyer J. Molecular characterization ofendolithic cyanobacteria inhabiting exposed dolomite in central Switzerland.Environmental Microbiology,2003,5(7):618-627.
[36]Burns BP,Goh F,Allen M,Neilan BA.Microbial diversity of extant stromatolites in the hypersaline marine environmentofshark bay, Australia. Environmental Microbiology,2004,6(10):1096-1101.
[37]Dong Z,Li Z,Wang F,Zhang M.Characteristics of atmospheric dust deposited in snow on Ürumqi Glacier No.1 of eastern Tian Shan,China:a comparison of measurements during asian dust period with non-dust Period.Environmental Science,2009,30(6):1818-1825.(in Chinese)董志文,李忠勤,王飞腾,张明军.天山乌鲁木齐河源冰川积雪内不溶粉尘特征:沙尘与非沙尘活动季节的比较.环境科学,2009,30(6):1818-1825.
(本文责编:王晋芳)
Community structure and phylogenetic analysis of cyanobacteria in cryoconite from surface of the Glacier No.1 in the Tianshan Mountains
Abstract:[Objective]The purpose of this study is to characterize the community composition and phylogenetic analysis of cyanobacteria from supraglacial cryoconite of the Glacier No.1 in the Tianshan Mountains,China.[Methods]We amplified 16S rRNA genes from the extracted cryoconite DNA by PCR with 2 pairs of cyanobacteria-specific primers. Amplificon was used to construct 16S rRNA genes clone library.The estimation of species richness,diversity indices,and rarefaction curve of the 16S rRNA genes library were determined based on representative phylotypes(OTUs).[Results]Analysis of 16S rRNA gene sequences allowed grouping of 101 clones into 12 phylotypes(OTUs)using a cut-off of 97% identity.The phylogenetic analysis revealed that most of sequences affiliated to the order Oscillatoriales and Chroococcales except that three were unclassified.The clone library was dominated by representatives of the order Oscillatoriales(81% of the total clones),and the most abundant organisms within this order were in the genus Phormidium(68 clones) including clones grouping into four phylotypes.The only clone of Chroococcales was closely related to the genus Chamaesiphon with 97% similarity.In addition,comparison of soil chemical properties between different habitats indicated that supraglacial cryoconite supported significantly higher the content of available phosphorus and potassium,nitrate nitrogen and organic matter compared with the forefield of the Glacier No.1.[Conclusion]The diversity index of cyanobacteria were relatively high in supraglacial cryoconite of the Glacier No.1 in the Tianshan Mountains.The community structure was dominated by members of the genus Phormidium.This study may enrich our knowledge on biogeochemical processes and ecological distribution of cyanobacterial populations in glacial ecosystem.
Keywords:Glacier cryoconite,Tianshan Mountains,Cyanobacteria,phylogenetic analysis
中图分类号:Q939
文章编号:0001-6209(2014)11-1256-11
doi:10.13343/j.cnki.wsxb.2014.11.003
基金项目:国家自然科学基金项目(40961002,41140009,41271268);冻土工程国家重点实验室开放基金项目(SKLFSE200903);中国博士后科学基金特别资助(20100339)
收稿日期:2014-01-09;
修回日期:2014-04-09
Supported by the National Natural Science Foundation of China(40961002,41140009,41271268),by the General and Special Program of the
