明永冰川融水中一株裂解性低温噬菌体的分离及特征
【类型】期刊
【作者】李明源,季秀玲,王宝强,张琦,林连兵,张兵,魏云林(昆明理工大学生物工程与技术研究中心;昆明理工大学国土资源工程学院)
【作者单位】昆明理工大学生物工程与技术研究中心;昆明理工大学国土资源工程学院
【刊名】微生物学报
【关键词】 明永冰川;低温噬菌体;分离;鉴定;Flavobacterium
【资助项】国家自然科学基金 (30960079,40961001);云南省后备人才基金项目 (2009CI027);中国科学院微生物研究所微生物资源前期开发国家重点实验室开放课题 (SKLMR...
【ISSN号】0001-6209
【页码】P236-242
【年份】2019
【期号】第2期
【期刊卷】1;|7;|8;|4;|5;|2;|12
【摘要】【目的】高山冰川是一类独特的生态系统,本研究探索从明永冰川地区分离和培养低温菌噬菌体,并对其特征进行研究。【方法】利用已分离的低温菌为宿主,采用"双层平板法"从明永冰川融水中分离纯化低温菌噬菌体;对噬菌体及其宿主进行电镜形态观察,并进行噬菌体基因组限制性酶切片段长度多态性分析、衣壳蛋白组成分析及噬菌体生理特征研究。【结果】从明永冰川融水中分离获得一株裂解性低温噬菌体,命名为MYSP03(Mingyong Flavobacterium Siphoviridae Bacteriophage),其宿主菌MYB03鉴定为Flavobacterium菌株。噬菌体MYSP03为长尾型,无囊膜,头部具典型的正多面体立体对称结构,直径约72 nm;尾管长约240 nm,直径约10 nm;4℃时具侵染活性,在4℃-20℃范围内均可产生边缘清晰、透明的噬菌斑,最适感染温度约10℃,pH耐受范围较广,最适感染pH约9.4,对氯仿不敏感,基因组为双链DNA,大小约66 kb。
【全文】 文献传递
明永冰川融水中一株裂解性低温噬菌体的分离及特征
摘要:【目的】高山冰川是一类独特的生态系统,本研究探索从明永冰川地区分离和培养低温菌噬菌体,并对其特征进行研究。【方法】利用已分离的低温菌为宿主,采用“双层平板法”从明永冰川融水中分离纯化低温菌噬菌体;对噬菌体及其宿主进行电镜形态观察,并进行噬菌体基因组限制性酶切片段长度多态性分析、衣壳蛋白组成分析及噬菌体生理特征研究。【结果】从明永冰川融水中分离获得一株裂解性低温噬菌体,命名为MYSP03(Mingyong Flavobacterium Siphoviridae Bacteriophage),其宿主菌MYB03鉴定为Flavobacterium菌株。噬菌体MYSP03为长尾型,无囊膜,头部具典型的正多面体立体对称结构,直径约72 nm;尾管长约240 nm,直径约10 nm;4℃时具侵染活性,在4℃-20℃范围内均可产生边缘清晰、透明的噬菌斑,最适感染温度约10℃,pH耐受范围较广,最适感染pH约9.4,对氯仿不敏感,基因组为双链DNA,大小约66 kb。
关键词:明永冰川,低温噬菌体,分离,鉴定,Flavobacterium
低温噬菌体(Cold-active bateriophages)是指在小于等于4℃的条件下能侵染宿主并增殖的细菌病毒[1]。噬菌体在低温生物圈中丰度非常高[2],并在控制微生物死亡率、调节微生物群落结构与多样性、影响微食物网过程以及参与碳、氮等元素的生物地球化学循环等方面扮演着重要的角色[3]。近年来,低温噬菌体已从各类栖息地包括两极地区、深海、永冻地带、冰雪冰川以及高纬度湖泊等环境中被发现,并且种类丰富[4]。在这些环境中,低温噬菌体被证明具有不可替代的生态作用[5-6]。在极地及深海中,噬菌体导致的细菌死亡已经等同甚至超过原生动物的捕食作用,成为调节低温环境下微食循环及微生物群落结构的重要因素[2,7];噬菌体介导的基因水平转移对维持宿主微生物遗传多样性同样具有重要影响[8-10]。目前对于低温噬菌体多样性的调查研究较多,但有关分离和鉴定可培养低温噬菌体的报道并不多见[10-11],低纬度冰川低温噬菌体的报道迄今未见。因此,低温特别是冰川环境中噬菌体的分离、鉴定及功能研究仍是一项非常重要而艰巨的任务。
明永冰川位于我国生物多样性最丰富的梅里雪山山系、三江并流区,是全球罕见的低纬度、低海拔、季风海洋性冰川[12]。该地区微生物多样性丰富,是分离低温微生物的理想场所[13]。目前关于冰川微生物的研究,许多科研工作者已将目光从低温细菌、真菌等有细胞结构的低温微生物逐步转移到无细胞结构的生命体-低温噬菌体上。对明永冰川及其退却地区的低温噬菌体进行分离、鉴定,不仅有助于了解噬菌体对该地区微生物多样性形成的贡献和影响,并将对认知生物多样性与环境的关系,探索生命与环境适应机制等具有重要科学意义。
本文报道了一株分离自明永冰川融水的黄杆菌低温噬菌体,并对其电镜形态、基因组限制性酶切片段多态性、蛋白组成及生理特征进行了初步研究。
1 材料和方法
1.1 样品采集
采集明永冰川冬季冰雪融水及沉积物(E98°81'18.4″、N28°47'33.0″),样品就地保存于无菌器皿中,在低温条件下运至实验室,采样点环境温度2-6℃,pH值5.4-6.0。
1.2 培养基
噬菌体分离及培养采用PYGV培养基(营养无机盐离子20 mL、蛋白胨0.25 g、酵母提取物0.25 g、25%的葡萄糖溶液10 mL、维生素溶液5 mL、加蒸馏水定容至1 L,pH值6.0)。固体培养基的琼脂浓度为1.8%,半固体培养基的琼脂糖浓度为0.4%。
1.3 低温菌及其噬菌体的分离
1.3.1 低温菌的分离:采用稀释涂布平板法进行低温菌分离,将不同稀释度的样品100μL涂布于PYGV固体平板上,15℃恒温倒置培养2-3 d,挑取不同(大小、形态、颜色等)特征的单菌落,划线纯化3次获得纯培养用作噬菌体分离的宿主菌。
1.3.2 噬菌体的分离:采用双层琼脂平板法[14]分离低温噬菌体,取50 mL样品于无菌条件下接种到等体积的PYGV液体培养基中,于15℃静置培养15 d,所得培养液经0.22 μm无菌滤膜过滤除菌后取100μL与300μL培养至对数生长期的宿主菌悬液混合,15℃静置吸附10 min后与3 mL冷却至40℃左右的半固体培养基混匀,均匀倾倒在PYGV固体平板上,形成双层平板。待双层平板完全凝固后15℃倒置培养1-2 d,观察到噬斑产生后,挑取单个噬斑重复双层平板3次以上进行噬菌体纯化。将纯化后的噬菌体接入含有宿主菌的PYGV液体培养基中进行增殖培养,培养液13000×g离心10 min,上清液经0.22 μm无菌滤膜过滤除菌后即得噬菌体原液。
1.3.3 宿主菌生长及噬菌体侵染温度范围:①将宿主菌接种于PYGV固体平板上,用胶带封口后分别置于4、10、15、20、25、30、37和45℃恒温培养48 h,分析宿主菌生长温度范围。②取噬菌体原液100μL与300μL培养至对数生长期的宿主菌悬液混合,15℃静置吸附10 min后与3 mL冷却至40℃左右的半固体培养基混匀,倒双层平板,并分别于4、10、15、20、25、30、37和45℃恒温倒置培养1-2 d,分析噬菌体侵染温度范围。
1.4 宿主菌及其噬菌体形态观察
将培养至对数生长期的宿主菌菌体用2%(W/V)的醋酸双氧铀染色后用透射电子显微镜观察;取效价为1×109pfu/mL以上的噬菌体纯培养液20μL,用2%(W/V)的醋酸双氧铀染色后用透射电子显微镜观察。
1.5 宿主菌总DNA提取、16S rRNA基因扩增及测序
宿主菌总DNA采用TaKaRa细菌基因组提取试剂盒提取,16S rRNA基因扩增采用细菌通用引物,正向引物f1:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物r2:5'-ACGGCTACCTTGTTACCACTT-3'。PCR产物经胶回收后,连接到pMD18-T载体上并转化E.coli DH5α感受态细胞,经过菌落蓝白斑筛选和质粒限制性酶切分析获得阳性克隆,并由北京奥科鼎盛生物技术有限公司完成测序。
1.6 物理及化学因素对噬菌体活性的影响
1.6.1 温度对噬菌体活性的影响:取效价1×108 pfu/mL的噬菌体纯培养液1 mL分别置于40℃、50℃、60℃和70℃水浴中,每隔10 min取样,测定不同时间各温度条件下噬菌体效价[10,15]。
1.6.2 pH值对噬菌体活性的影响:将pH值为3、4、5、6、7、8、9、10和11的缓冲液体系(柠檬酸缓冲液50 mmol/L,pH3、pH4、pH5;磷酸盐缓冲液50 m mol/L,pH6、pH7、pH8;Tris-Hcl缓冲液50 mmol/L,pH9;碳酸钠缓冲液50 mmol/L,pH10和pH11)0.99 mL加入1.5 mL的无菌Effendorf管中,再向各管中加入0.01 mL效价为1×108pfu/mL的噬菌体纯培养液,室温处理1 h后,测定不同pH条件下噬菌体效价。
1.6.3 氯仿、蛋白酶K及去垢剂等对噬菌体活性的影响:①氯仿对噬菌体活性的影响测定方法:将效价为1×108pfu/mL的噬菌体纯培养液与终浓度为25%(wt/v)的氯仿混合,室温处理10 min(不断颠倒),经13000×g离心1 min,取上清测定噬菌体效价。②去垢剂对噬菌体活性的影响测定方法:噬菌体纯培养液经0.3%(wt/v)Triton X-100室温处理10 min后测定效价;噬菌体纯培养液经0.1%SDS(wt/v)50℃处理6 min后测定效价。③蛋白酶K对噬菌体活性的影响测定方法:噬菌体纯培养液在缓冲液(10 mmol/L Tris-HCl,5 mmol/L EDTA)中经1 mg/mL蛋白酶K于56℃消化1 h后测定效价[16]。
1.7 噬菌体DNA提取及限制性酶切片段长度多态性分析
取效价1×109pfu/mL以上的噬菌体纯培养液10 mL,经11000×g,15 min离心2次,尽量去除培养液中的菌体及细胞碎片,收集上清液并加入DNAaseⅠ和RNaseA(终浓度为1μg/mL),37℃消化30 min,再加入EDTA(终浓度为20 m mol/mL)、蛋白酶K(终浓度为50μg/mL)和10%的SDS溶液(终浓度为50μL/mL),56℃水浴保温3 h,用酚/氯仿法抽提噬菌体DNA,再加入2.5×体积冰冷的无水乙醇和0.1×体积的3 mol/L的醋酸钠,-80℃静置30 min后,经4℃,11000×g离心5 min,沉淀用冰冷的70%乙醇洗涤2次,自然晾干,用50μL双蒸水重悬沉淀,即为噬菌体基因组样品,再分别用EcoRⅠ、XbaⅠ、NcoⅠ和NdeⅠ进行酶切,酶切产物及基因组样品经0.7%琼脂糖凝胶电泳进行分析。
1.8 噬菌体衣壳蛋白组成分析
取效价1×109pfu/mL以上的噬菌体纯培养液1 L,经4℃,11000×g,15 min离心2次,尽量去除培养液中的菌体及其碎片,向上清液中加入DNAaseⅠ和RNase A(终浓度为1μg/mL),37℃消化30 min后加入NaCL至终浓度为1 mol/L,缓慢搅拌使NaCL完全溶解,冰浴1 h,再经4℃,13000×g离心15 min,收集上清液并边缓慢搅拌边加入PEG8000至终浓度为10%(W/V),待PEG8000完全溶解后,置于4℃冰箱静置过夜。所得溶液经4℃,13000×g离心15 min收集噬菌体沉淀,用16 mL SM缓冲液重悬,经等体积的氯仿抽提2次,于13000×g离心5 min后收集亲水相,并加入CsCL至终浓度为0.5 g/mL,搅拌使其充分溶解后分装于离心管中,40000 r/min,4℃,离心24 h收集噬菌体条带,制备样品用于SDS-PAGE电泳以分析噬菌体MYSP03蛋白组成[17]。
2 结果
2.1 低温菌及其裂解性噬菌体的分离
从采集样品中分离到37株低温细菌菌株,并分离获得一株特异性低温噬菌体,命名为MYSP03。宿主菌MYB03的16SrRNA基因序列与Flavobacterium菌株相似度达99%,初步鉴定命名为Flavobacterium sp.MYB03。噬菌体MYSP03能于双层平板上形成边缘清晰、透明的噬菌斑,培养24 h后,噬菌斑直径可达4 mm。
2.2 宿主菌生长及噬菌体侵染温度范围
宿主菌MYB03可在4℃-30℃范围内生长(见表1),最适生长温度约为15℃;噬菌体MYSP03能在4℃-20℃形成边缘清晰、透明的噬菌斑,最适侵染温度约10℃,在4℃时能够侵染宿主并增殖,为一株典型的低温噬菌体。
表1 宿主菌MYB03生长及噬菌体MYSP03侵染温度范围
Table 1 Growth of host strain MYB03 and plaque development of phage MYSP03 at different temperatures
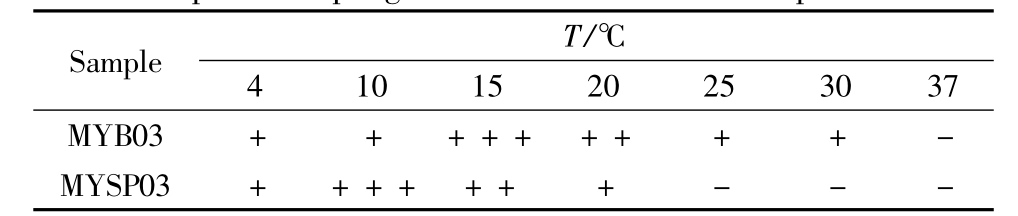
“+”means growth and infection were observed,“-”means growth and infection were not observed.
SampleT/℃4101520253037 MYB03+++++++++-MYSP03+++++++---
2.3 噬菌体及其宿主菌形态
噬菌体MYSP03为头尾复合结构,具典型的正多面体立体对称头部,直径约72 nm;尾管不易弯曲,长约240 nm,直径约10 nm;MYSP03具有长尾噬菌体的典型特征,属长尾噬菌体科(图1)。
2.4 物理及化学因素对噬菌体活性的影响
2.4.1 温度对噬菌体活性的影响:噬菌体MYSP03可在4℃-20℃感染其宿主菌并增殖,热稳定性分析表明:MYSP03热稳定性较差,40℃处理60 min,存活率为53%;50℃处理60 min,存活率仅20%;随着温度的升高,噬菌体存活率迅速下降,在60℃保温处理20 min后,只有不到5%的存活率;70℃处理10 min,则噬菌体完全失活(图2)。这与分离自深海的低温希瓦氏菌噬菌体SW1相似[10]。
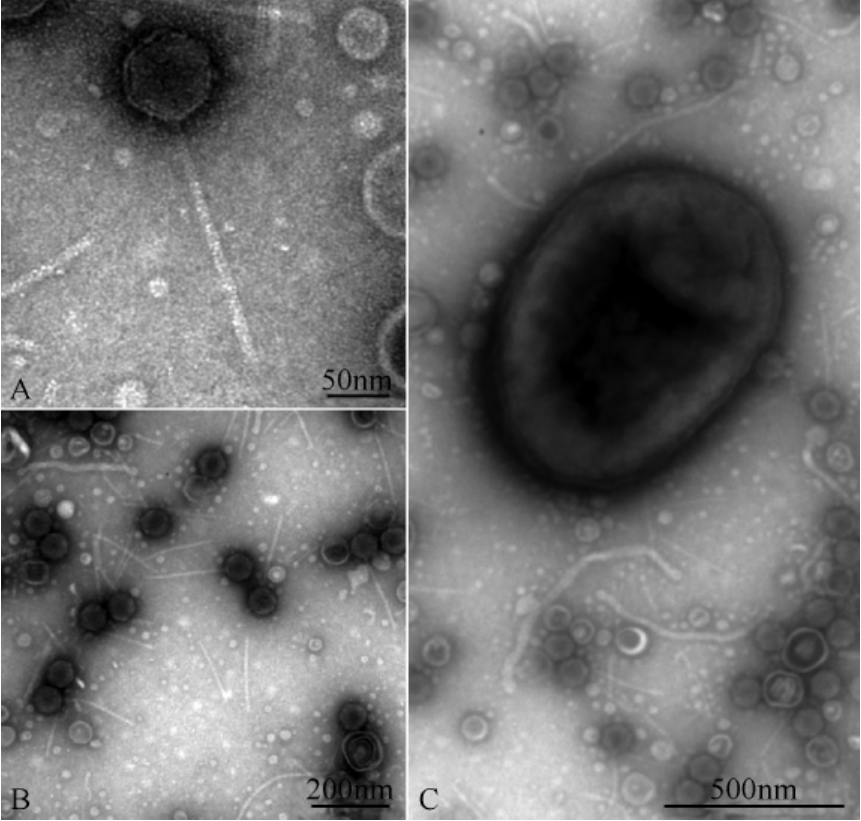
图1 噬菌体MYSP03及其宿主电镜形态
Fig.1 Electron microscopy of phage MYSP03.A,B:MYSP03 viral particles.C:Host cell of MYSP03.
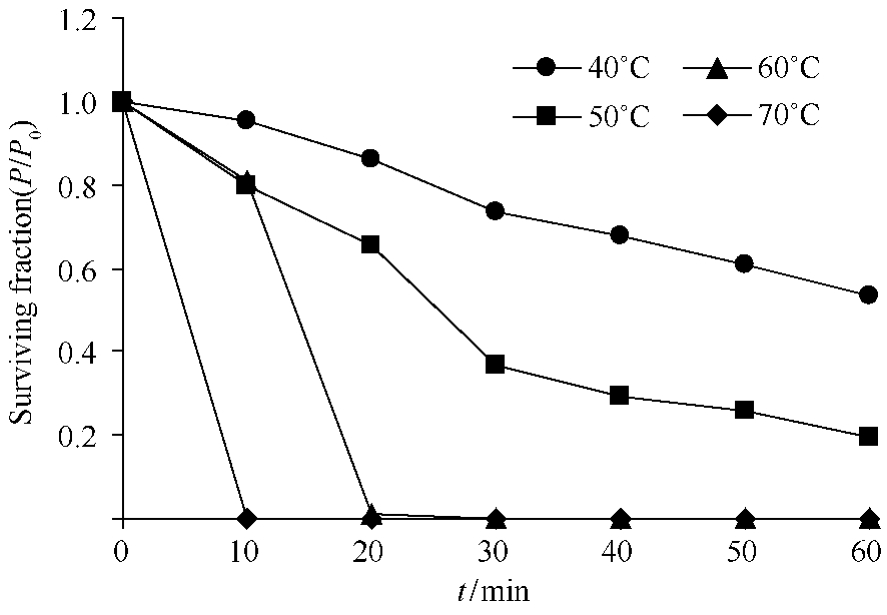
图2 噬菌体MYSP03温度耐受性
Fig.2 Thermostability of phage MYSP03 surviving fraction:P/P0is plotted,P0means the MYSP03 initial titer and P represents the mean titer from triplicate assays after incubation for 60 min at different temperatures.
2.4.2 pH值对噬菌体活性的影响:噬菌体对宿主菌的感染活性与环境pH关系密切,但pH的改变对噬菌体MYSP03的感染活性影响不显著,MYSP03偏好碱性环境,对酸性条件具有一定的耐受性,在pH7-10时活性较好,能够保持90%以上的效价,pH9.4时效价最高;而随着pH减小,噬菌体MYSP03的活性逐渐降低,但在pH3时仍具有60%以上的效价,相比而言,MYSP03在碱性环境中稳定性较好,但有较宽的pH适应范围(图3)。

图3 pH对噬菌体MYSP3的影响
Fig.3 pH sensitivity of phage MYSP03 surviving fraction:P/P0is plotted,P0means the initial titer of MYSP03,and P represents the mean titer from triplicate assays after incubation for 1h at different pH.
2.4.3 氯仿、蛋白酶K及去垢剂等对噬菌体活性的影响:噬菌体MYSP03对氯仿不敏感,经氯仿处理10 min后仍保留82%以上的效价,表明其衣壳蛋白无脂质包膜。但其对离子型去垢剂SDS较为敏感,处理后只剩余11%的效价;而对非离子型去垢剂Triton X-100不敏感,经过处理,其效价仍可达92%;而经蛋白酶K处理,其侵染活性几乎完全丧失。根据结果推断MYSP03衣壳蛋白结构具有一定的特异性,Triton X-100较温和,不致使其衣壳蛋白完全变性失活;而强变性剂SDS则与衣壳蛋白结合,并破坏了其内部结构,使其完全变性失活。
2.5 限制性酶切片段长度多态性分析
噬菌体MYSP03的基因组为双链DNA,能被EcoRⅠ、XbaⅠ、NcoⅠ和NdeⅠ酶切成多条大小不同的片段,根据酶切图谱(图4),初步估算其基因组DNA大小约为66 kb。
2.6 噬菌体MYSP03蛋白组成分析
噬菌体MYSP03蛋白组成SDS-PAGE电泳结果见图4,根据图谱所示,MYSP03蛋白组成共有4条主要条带,初步估算其大小(由上到下)分别约为40、37、32和13 kDa,其中40、37和13 kDa 3条主条带含量较高,推测可能为其重要的结构蛋白。
3 讨论
黄杆菌属细菌及其噬菌体广泛分布于土壤、淡水、海洋等环境,大多能在低温条件下生长,目前已从一些极端环境如极地、深海中分离到了黄杆菌低温噬菌体[18]。这些噬菌体分别属于长尾噬菌体科(Siphoviridae)、短尾噬菌体科(Podoviridae)和肌尾噬菌体科(Myoviridae),但有关陆地冰川黄杆菌噬菌体的研究至今未见报道。

图4 噬菌体MYSP03基因组DNA限制性酶切图谱
Fig.4 Restriction endonuclease digestion patterns of MYSP03 DNA.M1.λ-HindⅢdigest DNA marker;1.PurifiedMYSP03DNA;2.MYSP03 DNA digested with EcoRⅠ;3.MYSP03 DNA digested with XbaⅠ;4.MYSP03 DNA digested with NcoⅠ;5.MYSP03 DNA digested with NdeⅠ;M2.DL15000 digest DNA marker.
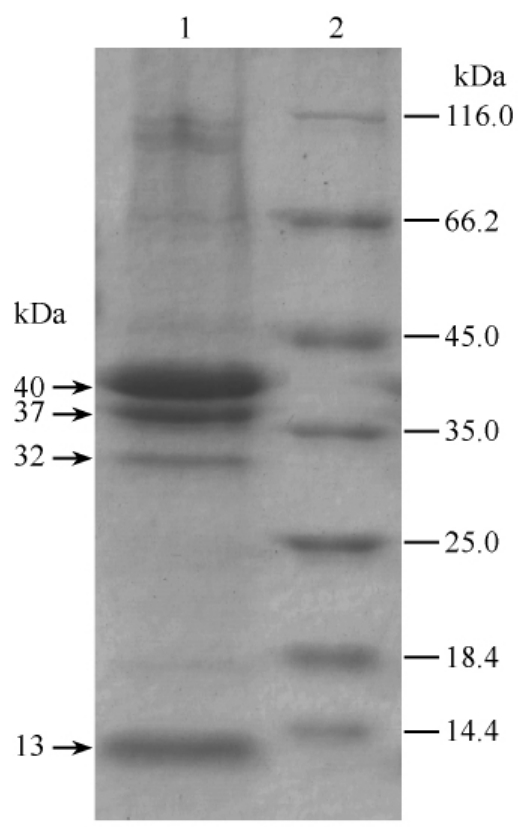
图5 噬菌体MYSP03组成蛋白的SDS-PAGE分析
Fig.5 SDS-PAGE analysis of MYSP03 constituent proteins.Lane 1,purified MYSP03 constituent proteins.Lane 2,protein marker.
明永冰川地区低温细菌多样性分析表明假单胞菌属和黄杆菌属为该环境中的主要类群[13],进一步研究发现该地区也存在大量相应的低温噬菌体[22]。本研究从明永冰川融水中分离到一株裂解性黄杆菌长尾噬菌体MYSP03,其在4℃时仍具侵染活性,为典型的低温噬菌体。从形态上看,MYSP03与分离自北冰洋的长尾噬菌体11b和21c存在明显差异,其正多面体头部直径(72 nm)明显大于11b(40 nm)和21c(50 nm)[11],而其尾管(240 nm)长于21c(180 nm),约为11b的3倍;从蛋白组成看,MYSP03与11b在14 kDa和40 kDa附近都有一条主蛋白带,可能是其衣壳蛋白的主要组分;从基因组大小看,MYSP03的ds DNA基因组(66 kb)相比11b(30 kb)和21c(40-50 kb)要大得多,这也许是其头部直径比11b和21c大的原因之一。以上特征表明MYSP03从形态特征、基因组大小及衣壳蛋白组成都与目前已报道的长尾低温噬菌体有所不同。此外,低温噬菌体的增殖对低温具有较高的依赖性[11],感染增殖的最高温度往往低于宿主的最高生长温度[1,10]。MYSP03也不例外,只能在4℃-20℃形成噬菌斑,而其宿主的最高生长温度可达30℃;11b和21c的感染温度范围较窄,分别为0℃-10℃和0℃-5℃,其宿主最高生长温度为20℃。相比11b和21c,MYSP03的感染温度范围宽,最适感染温度高,造成这种差异的原因很可能缘于它们分离环境的不同,MYSP03来源于冰川融水,其温度受日照、季节的影响很大,而且高原内陆普遍昼夜温差大,因此导致MYSP03具有较宽的温度适应范围,而11b和21c则分离自常年温度变化不大的北冰洋,这可能是在长期的进化过程中对生存环境定向选择的结果。11b是目前唯一完成全基因组测序的黄杆菌低温噬菌体,在对其基因组进行解析时发现了许多有趣的现象,如G+C含量仅为30.6%,是目前已测序的革兰氏阴性细菌噬菌体中最低的一个。MYSP03与其它黄杆菌低温噬菌体在结构上差异明显,因此进一步对其基因组进行测序和解析无疑将有助于探索低温噬菌体的适应性机制以及比较不同地理条件下噬菌体类型与基因组成上的差异。
噬菌体具有丰富的多样性,由于其独特的结构和代谢特征自被发现以来就倍受科学家的关注。而低温噬菌体作为最重要的生物调节因子在探讨一些特殊环境如海洋及冰川的生态学问题中意义重大[23-24],明永冰川作为我国纬度及冰舌下沿海拔最低的热带季风海洋性冰川,对其中的低温噬菌体进行分离及性质研究无疑将对我们深入探索噬菌体对冰川微生物多样性的影响及微生物适冷机制研究提供很大方便,同时也有助于阐明低温噬菌体与宿主及环境的相互作用规律。
参考文献
[1]Wells LE,Deming JW.Characterization of a cold-active bacteriophage on two psychrophilic marine hosts.Aquatic Microbial Ecology,2006b,45(1):15-29.
[2]Lopez-Bueno A,Tamames J,Velazquez D,Moya A,Quesada A,Alcami A.High diversity of the viral community from an Antarctic lake.Science,2009,326(5954):858-861.
[3]张永雨,黄春晓,杨军,焦念志.海洋微生物与噬菌体间的相互关系.科学通报(Chinese Science Bulletin),2011,56(14):1071-1079.
[4]Sawstrom C,Graneli W,Laybourn-Parry J,Anesio AM.Highviral infection rates in Antarctic and Arctic bacterioplankton.Environmental Microbiology,2007,9(1):250-255.
[5]Danovaro R,Dell'Anno A,Corinaldesi C,Magagnini M,Noble R,Tamburini C,Weinbauer M.Major viral impact on the functioning of benthicdeep-sea ecosystems.Nature,2008,454(7208):1084-1087.
[6]Desnues C,Rodriguez-Brito B,Rayhawk S,Kelley S,Tran T,Haynes M,Liu H,Furlan M,Wegley L,Chau B,Ruan Y,Hall D,Angly FE,Edwards RA,Li L,Thurber RV,Reid RP,Siefert J,Souza V,Valentine DL,Swan BK,Breitbart M,Rohwer F.Biodiversity and biogeography of phages in modern stromatolites and thrombolites.Nature,2008,452(7185):340-343.
[7]Suttle CA.Marine viruses—major players in the global ecosystem.Nature Reviews Microbiology,2007,5(10):801-812.
[8]Mann NH,Cook A,Millard A,Bailey S,Clokie M.Marine ecosystems:bacterial photosynthesis genes in a virus.Nature,2003,424(6950):741.
[9]Williamson SJ,Rusch DB,Yooseph S,Halpern AL,HeidelbergKB,GlassJI,Andrews-PfannkochC,Fadrosh D,Miller CS,Sutton G,Frazier M,Venter JC.The Sorcerer II Global Ocean Sampling Expedition:metagenomic characterization of viruses within aquatic microbial samples.PLoS One,2008,3(1):e1456.Published online 2008 January 23.
[10]Wang F,Li Q,Xiao X.A novel filamentous phage from the deep-sea bacterium Shewanella piezotolerans WP3 is induced at low temperature.Journal of Bacteriology,2007,189(19):7151-7153.
[11]Borriss M,Helmke E,Hanschke R,Schweder T.Isolation and characterization of marine psychrophilic phage-host systems from Arctic sea ice.Extremophiles,2003,7(5):377-384.
[12]郑本兴,赵希涛,李铁松,王存玉.梅里雪山明永冰川的特征与变化.冰川冻土(Journal of Glaciology and Geocryology),1999,21(2):145-150
[13]周长涛.明永冰川低温微生物多样性初步研究.昆明理工大学硕士学位论文,2007.
[14]Martha RJ,Clokie AM.Bacteriophages:Methods and Protocols,Volume 1:Isolation,Characterization,and Interaction.Print ISBN:978-1-58829-682-5.Humana Press,2008.
[15]Colasito DJ,RogoffMH.Characterization of lytic bacteriophages of Bacillus thuringiensis.Journalof General Virology,1969,5(2):267-274.
[16]Geslin C,Gaillard M,Flament D,Rouault K,Le Romancer M,Prieur D,Erauso G.Analysis of the first genome of a hyperthermophilic marine virus-like particle,PAV1,isolated from Pyrococcus abyssi.Journal of Bacteriology,2007,189(12):4510-4519.
[17]Ye T,Zhang X.Characterization of a lysin from deepsea thermophilic bacteriophage GVE2.Applied Microbiology and Biotechnology,2008,78(4):635-641.
[18]Stenholm AR,Dalsgaard I,Middelboe M.Isolation and characterization of bacteriophages infecting the fish pathogen Flavobacterium psychrophilum.Applied and Environmental Microbiology,2008,74(13):4070-4078.
[19]Kim JH,Gomez DK,Nakai T,Park SC.Isolation and identification of bacteriophages infecting ayu Plecoglossus altivelis altivelis specific Flavobacterium psychrophilum.Veterinary Microbiology,2010,140(1-2):109-115.
[20]Holmfeldt K,Middelboe M,Nybroe O,Riemann L.Large variabilities in host strain susceptibility and phage host range govern interactions between lytic marine phages and their Flavobacterium hosts.Applied and Environmental Microbiology,2007,73(21):6730-6739.
[21]Borriss M,Lombardot T,Glockner FO,Becher D,AlbrechtD,SchwederT.Genomeandproteome characterization of the psychrophilic Flavobacterium bacteriophage 11b.Extremophiles,2007,11(1):95-104.
[22]赵龙.荧光假单胞菌低温噬菌体的分离及特性.昆明理工大学硕士学位论文,2010.
[23]Middelboe M,Glud RN,Wenzhöfer F,Oguri K,and Kitazato H.Spatial distribution and activity of viruses in the deep-sea sediments of Sagami Bay,Japan.Deep Sea Research,2006,53(1):1-13.
[24]Madan NJ,Marshall WA,Larbourn-Parry J.Virus and microbial loop dynamics over and annual cycle in three contrasting Antarctic lakes.Freshwater Biology,2005,50(8):1291-1300.
Isolation and characterization of a lytic bacteriophage from Mingyong glacier melt water
Abstract:[Objective]Glacier is a unique ecological system.This study focused on the isolation and characterization of a cold-active bateriophage from Mingyong glacier area in northwest Yunnan.[Methods]Bacterial strains isolated from glacial melt water were used as host cells to isolate and purify bacteriophages by double-layer plate method.The morphology of the isolated phages and their host strains were observed by electron microscope.Restriction fragment length polymorphism(RFLP)analysis of genomic DNA,constituent proteins and physiological analysis of the bacteriophages were further carried out to characterize the phages.[Results]A lytic cold-active bacteriophage,designated as MYSP03,was isolated from Mingyong glacier.Its host strain MYB03 was identified as a member of genus Flavobacterium,based on the 16S rRNA sequence analysis.The bacteriophage MYSP03 has a isometric head(about 72 nm in diameter)and a long tail(about 240 nm in length and 10 nm in width),but no envelope was detected.Physiological analysis results showed that MYSP03 had infection activity at 4℃,and clear and transparent plaques were formed on double-layer plates between 4 and 20℃.Its optimum infection temperature was 10℃and optimal pH 9.4,respectively.It is insensitive to chloroform.Furthermore,the genome of MYSP03 consists of double-stranded DNA and is approximately 66 kb.
Keywords:Mingyong Glacier,cold-active bateriophage,isolation,characterization,Flavobacterium
Supported by the National Nature Science Foundation of China(30960079,40961001),by the Foundation for Candidates of the Young and Middle Aged Academic Leaders of Yunnan Province(2009CI027)and by the The State Key Laboratory of Microbial Resources,Institute of Microbiology,Chinese Academy of Sciences(SKLMR-20110606)
中图分类号:X172
文献标识码:A
文章编号:0001-6209(2012)02-0236-07
基金项目:国家自然科学基金(30960079,40961001);云南省后备人才基金项目(2009CI027);中国科学院微生物研究所微生物资源前期开发国家重点实验室开放课题(SKLMR-20110606)
收稿日期:2011-11-04;
修回日期:2011-12-16
