环境因素主导着冰川前沿裸露地好氧异养细菌群落的分布
【类型】期刊
【作者】章高森,张威,刘光琇,安黎哲,陈拓,李忠勤(中国科学院寒区旱区环境与工程研究所沙漠与沙漠化重点实验室;兰州大学生命科学学院;中国科学院寒区旱区环境与工程研究所冰冻圈科学国家重点实验室)
【作者单位】中国科学院寒区旱区环境与工程研究所沙漠与沙漠化重点实验室;兰州大学生命科学学院;中国科学院寒区旱区环境与工程研究所冰冻圈科学国家重点实验室
【刊名】冰川冻土
【关键词】 冰川前沿裸露地;微生物;微生物群落演替;环境因素
【资助项】国家自然科学基金项目 (40971034;31170465;31100365);国家重点基础研究发展计划(973计划)项目 (2012CB026105);国家国际科技合作专项项目...
【ISSN号】1000-0240
【页码】P965-971
【年份】2019
【期号】第4期
【期刊卷】1;|7;|8;|2
【摘要】冰川前沿裸露地有着暴露年代序列特性,是研究微生物群落结构时空变化的理想地区.通过对1号冰川东支前沿裸露地的微生物学研究发现,从冰土交界处到1675年的冰碛垄,25℃下培养得到细菌数量从5.5×104 CFUs.g-1增加到3.3×106 CFUs.g-1,而微生物总数的变化在暴露年代序列上都没有显著的相关关系;细菌群落结构的主要改变发生在两个阶段,暴露初期和植被盖度明显增加的时候.联系到这两个阶段正好是环境温度与土壤营养水平改变的时期,此结果表明,环境变化是冰川前沿裸露地微生物群落时空变化的主要驱动力.
【全文】 文献传递
环境因素主导着冰川前沿裸露地好氧异养细菌群落的分布
摘 要:冰川前沿裸露地有着暴露年代序列特性,是研究微生物群落结构时空变化的理想地区.通过对1号冰川东支前沿裸露地的微生物学研究发现,从冰土交界处到1675年的冰碛垄,25℃下培养得到细菌数量从5.5×104 CFUs·g-1增加到3.3×106 CFUs·g-1,而微生物总数的变化在暴露年代序列上都没有显著的相关关系;细菌群落结构的主要改变发生在两个阶段,暴露初期和植被盖度明显增加的时候.联系到这两个阶段正好是环境温度与土壤营养水平改变的时期,此结果表明,环境变化是冰川前沿裸露地微生物群落时空变化的主要驱动力.
关键词:冰川前沿裸露地;微生物;微生物群落演替;环境因素
0 引言
政府间气候变化委员会(IPCC)指出[1],在过去的100a里,全球平均温度升高了0.74℃.受此气候变化的影响,冰川也发生持续的退缩[2].冰川前沿因冰川逐步退缩而形成的裸露地,具有暴露时间上的年代序列特性,因此,冰川退缩区被认为是研究生物群落演替的一个理想区域[3].对不同冰川退缩区的植物群落进行调查发现,植物物种丰富度随着暴露年份的增加而增长[4-7].这些结果不仅给植物原生演替研究提供了新的资料和知识,也进一步激发了微生物生态学家对冰川退缩区进行微生物时空变化研究的热情.
然而,在对冰川前沿裸露地微生物群落演替的研究中,却出现相互矛盾的结果:一些研究报道冰川前沿细菌系统发育类型多样性随着暴露年份的增长而增加[8-10];也有研究则发现多样性在减少[11];还有研究称微生物多样性在冰川前沿没有增加或减少的趋势[12].这些微生物多样性变化在冰川前沿出现各不相同的现象,有着多种的原因.与冰川前沿裸露地植物的分布不同,微生物群落演替不是一个像植物那样从无到有、从零星分布到群落稳定的过程.无论在冰土交界处还是在未消融的冰雪中,一直有微生物群落存在[13-14].冰川前沿裸露地的微生物群落演替是群落结构随环境改变而变化的过程,各地冰川在环境因素上的不同,会引起群落结构变化上的差异.
考虑以上因素,本研究以观测资料丰富的天山乌鲁木齐河源1号冰川(以下简称1号冰川)东支前沿裸露地为研究对象,从冰川前沿冰土交界处的温度比裸露地的温度变化更小这一特点出发,通过基于培养的方案,分析从冰土交界处到已暴露300多年的冰碛垄这一退缩路线的样品,对冰川前沿裸露地的微生物群落结构在退缩路线上的变化特点进行研究,并结合其他冰川前沿微生物学研究结果,阐明造成微生物群落结构改变的主要驱动因素.
1 材料与方法
1.1 样品采集
采样点位于1号冰川东支前沿裸露地,采样工作在2007年10月完成.根据1号冰川退缩记录,按2006、2005、2003、1999、1995、1990、1986、1973和1962年冰川前沿位置,以及冰川前沿冰土交界处和3道冰碛垄,共采集13个样品.采样时去除表层土壤,取2~5cm处的土壤样品.样品放置于预先灭菌处理好的土壤盒中,低温下运回实验室,立即进行土壤理化性质分析和和好氧异养细菌的培养,余下样品储存于-20℃备用.
1.2 土壤理化性质分析
其中水分含量通过烘干法测定,pH用酸度计(PB-10,Sartorius)来分析水/土(1∶1,w/v)混合物,总氮含量和碳含量使用Dumas 燃烧法,在1 800℃燃烧测定(GmbH VarioEL,Elementar Analysensystem).
1.3 微生物总数测定和好氧异养细菌的分离、纯化及保存
此在超净台中取土样2g,置于一灭菌处理的装有18mL生理盐水(0.85%)和玻璃珠的三角瓶中,250rpm摇振15min,取悬液进行梯度稀释.在稀释100倍的土壤悬液中按2μg·mL-1的标准加入DAPI,染色10~20min,DAPI染色完毕后,将溶液过滤到聚碳酸酯滤膜上,使用荧光显微镜观察并计数,激发光波长为364nm,发射光波长454 nm[15].另取稀释100倍和1 000倍的土壤悬液200 μL涂布到PYGV固体培养基上[16],于4℃和25℃下避光培养,每个样品的每个梯度都做3个平行,观察菌落形成情况,4℃培养的到30d时进行菌落计数,25℃培养的在7d时进行菌落计数,并选取不同颜色形态的菌落,通过划线法纯化后,挑取单菌落摇培成菌液,加入15%甘油冷冻于-80℃冰柜进行保存.
1.4 测序分析和系统发育学分析
近乎全长的16SrRNA基因片段通过引物8F和1492R进行扩增而获得[17],扩增产物使用限制性内切酶HaeIII和HhaI进行RFLP分析后,所有具不同带谱的菌株进行16SrRNA基因序列测定[18].测序工作在上海生工生物工程有限公司完成,获得的38条16SrRNA基因接近全长的序列,进一步通过嵌合体(chimera)分析后[19]提交至GeneBank,序列号为JX096988-JX097025.
最相近的参比序列从GenBank数据库中通过BLAST搜索工具获得[20],与所测序列通过CLUSTALW 2.0进行多序列比对[21],比对结果用邻位相连法分析后[22],使用MEGA5.0构建系统发育树[23],并通过Bootstrap法对树型进行评估分析[24].
2 结果
2.1 土壤理化性质分析

图1 采样地点
Fig.1 The sampling sites
表1 土壤样品的理化性质
Table 1 Physicochemical property of the investigated soil samples
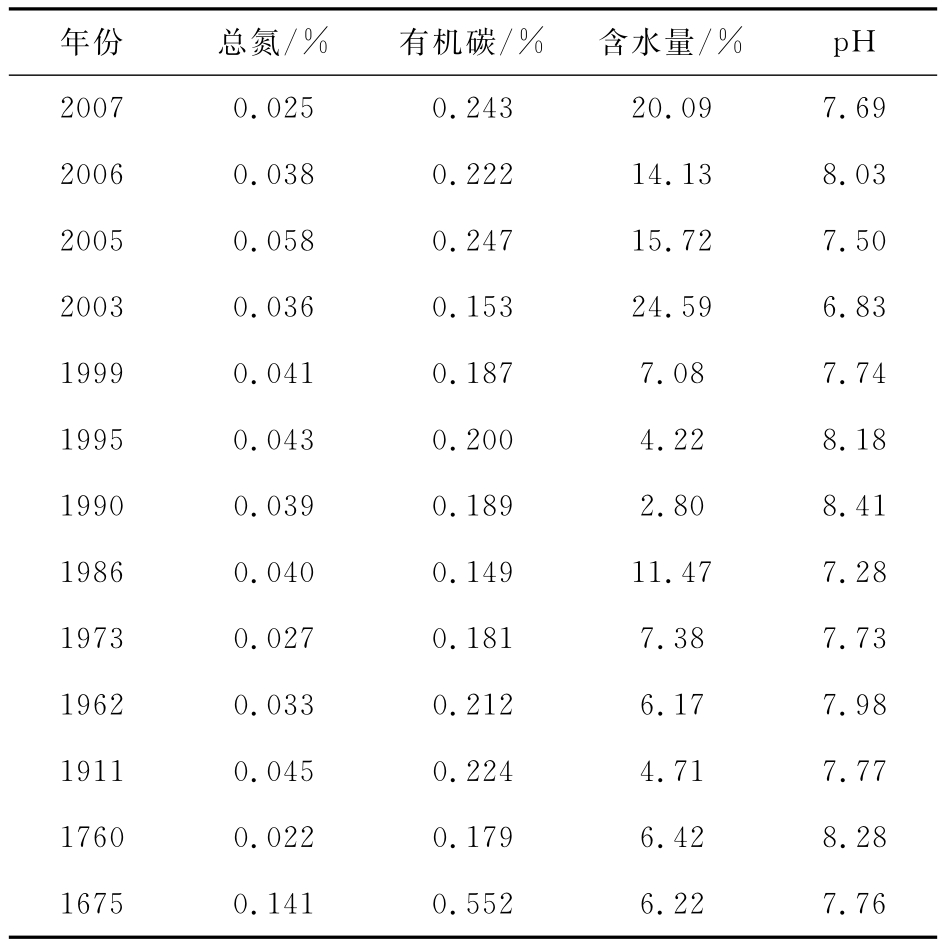
年份 总氮/% 有机碳/% 含水量/% pH 2007 0.025 0.243 20.09 7.69 2006 0.038 0.222 14.13 8.03 2005 0.058 0.247 15.72 7.50 2003 0.036 0.153 24.59 6.83 1999 0.041 0.187 7.08 7.74 1995 0.043 0.200 4.22 8.18 1990 0.039 0.189 2.80 8.41 1986 0.040 0.149 11.47 7.28 1973 0.027 0.181 7.38 7.73 1962 0.033 0.212 6.17 7.98 1911 0.045 0.224 4.71 7.77 1760 0.022 0.179 6.42 8.28 1675 0.141 0.552 6.22 7.76
如图1所示,冰川末端前沿直至1760年的冰碛垄处,植被盖度很低,所选取取样点位置皆避开植物,到1675年冰碛垄处,植被盖度约为17%,取样容易遇到植物根系.碳氮分析发现(表1),除1675年冰碛垄处的样品外,表层冻土的总氮和有机碳含量都比较低,其中氮含量不超过0.45‰,有机碳含量低于2.5‰,但在植被盖度稍稍增高的样品,总氮和有机碳含量增加了约3倍.样品的含水量变化比较大,在2.8%~24.59%波动,其中靠近冰川末端的土样含水量明显比较高.样品的pH值变化不大,绝大多数样品呈中性或弱碱性.
2.2 可培养细菌的数量和微生物总数
25℃下培养的细菌数量随退缩年龄增加有所增加,从冰土交界处到最后一道冰碛垄,数量从5.5×104CFUs·g-1增加到3.3×106 CFUs·g-1.4℃下培养的细菌数量在此两个数值之间波动,但数量变化与冰川退缩时间没有显著相关关系(图2).在已经报道的工作中[25-28],南极、西伯利亚冻原、青藏高原等地区表层冻土中可培养细菌的数量与我们的结果接近.通过采用低温(4℃)和室温(25℃)两个培养温度研究发现,低温培养通常可以比室温培养获得更多细菌菌落,说明在冰川前沿冻土中的微生物更适应低温环境,这与当地年平均气温低于-3.9℃的情况相符合.
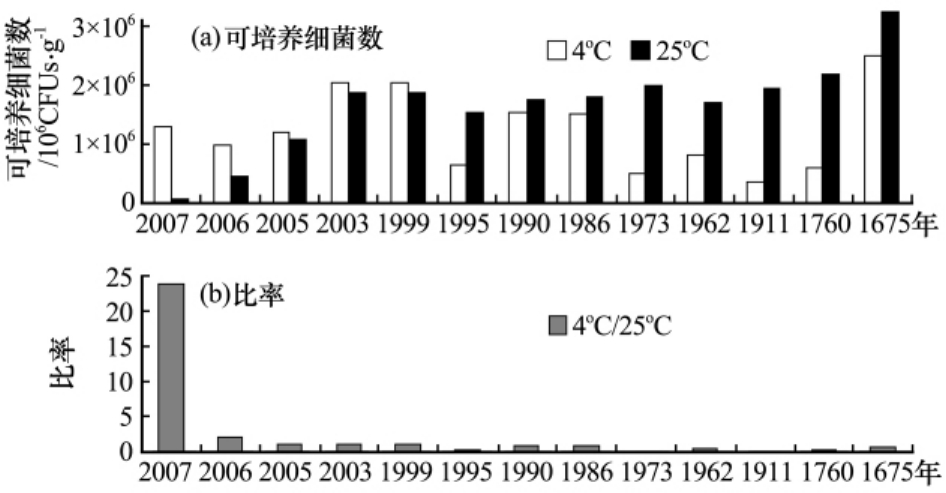
图2 不同温度下可培养细菌数量及比率(4℃/25℃)
Fig.2 The number and the ratios of culturable bacteria(The first histograms are numbers of colony forming units(CFUs).The second histograms show their ratios of CFUs from the plates incubated at 4oC versus those from 25℃)
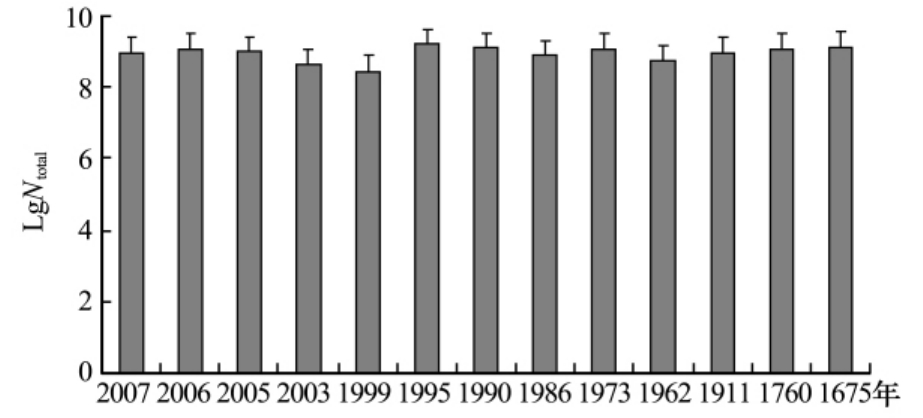
图3 土样品中微生物总数
Fig.3 The total microorganisms in soil samples
结果中比较有意思的现象是,尽管我们取样的时候,所有样品都处于冻结状态,但取自冰土交界处的样品(2007年)中低温/室温下可培养细菌数量比例要比其他所有样品高得多.然而,对此样品4℃下获得的菌落再置于25℃下培养时,所有菌株都能快速生长,未发现有专性嗜冷微生物.
微生物总数在在2.8×108~1.6×109个·g-1(图3)土壤之间,从冰土交界处到1675年冰碛垄处,数量有波动,但没有显著增加或减少的变化趋势.
2.3 可培养细菌的多样性及变化
通过对可培养细菌菌株进行ARDRA分析、16SrRNA基因测序并进行系统发育分析,结果显示:1号冰川前沿冻土中可培养细菌分别属于19个不同的属,在绝大多数样品中,优势菌株都来自于Flavobacterium属和Brevundimonas属(图4).对于优势菌株,它们在4℃和25℃培养同时出现菌落,而非优势菌株只是从不同的样品在不同培养随机出现.这导致大多数样品中可培养细菌的群落结构接近,其中只有1675年冰碛垄样品除外,在这个来自植被丰富地点的样品中,Bacillus属的菌株丰富度最高,另外也有来自Leclercia、Chryseobacterium、Variovorax等属的菌株.
除1675年冰碛垄样品外,在其余12个样品中Flavobacterium属和Brevundimonas属的菌株占据了很大比例,对这些菌株的丰富度之和分析发现,Flavobacterium属的菌株在接近冰川末端的样品中占有更多的比例,随着冰川消融,冻土的暴露时间延长,该属内的菌株丰富度逐渐下降(图5).作为相对应的,来自于Brevundimonas属的菌株却逐渐占据更多的比例.
然而,无论4℃还是25℃下培养,出现的菌落形态学特征相似,进一步培养发现,所有这些菌株在25℃下的生长速率都比在4℃下快.结果说明无论来自Flavobacterium属还是Brevundimonas属的菌株都是耐冷菌株,并非嗜冷菌,它们能耐受长期冰川覆盖下的低温环境,但低温并不是最适宜生长的环境,在冰川融化,环境温度有所升高时,这些菌株的活性更强.
3 讨论
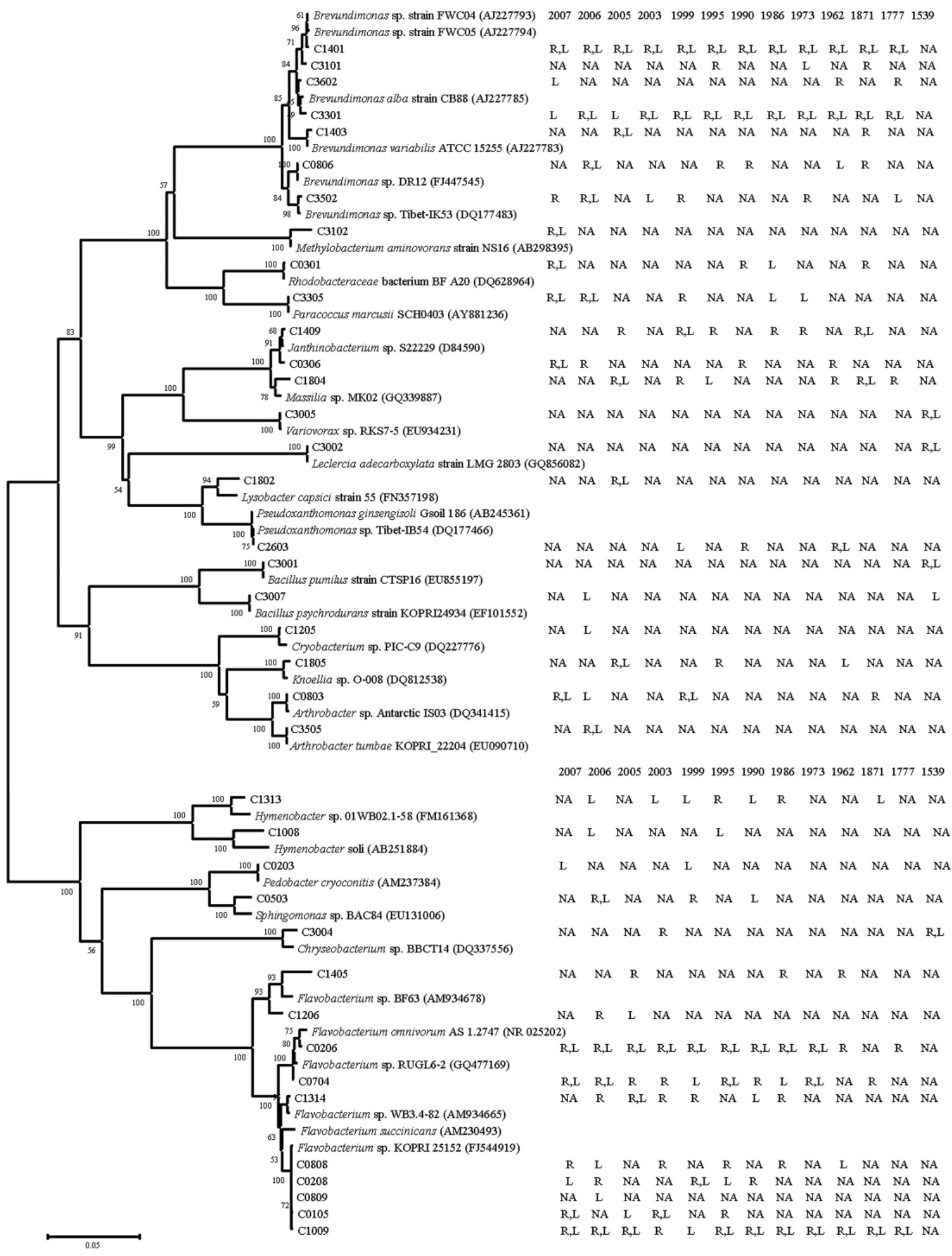
图4 可培养细菌的邻接法系统发育树及菌株分布“R”、“L”分别为菌株在室温培养(25℃)、低温培养(4℃)下出现;“NA”为未出现
Fig.4 Phylogenetic diversity and occurrence of culturable bacteria(The tree created by the neighborjoining method.The numbers on the tree indicate the percentages of bootstrap sampling derived from 1,000 replications.Bar,2inferred nucleotide substitutions per 100nucleotides.“R”and“L”refer the corresponding phylotype occurred in the plates incubacted at 25℃and 4℃,respectively.Whereas“NA”means no occurrence)
在冰川前沿裸露地区域,沿冰川退缩路线上具有暴露时间上的年代序列特性,是分析微生物时空变化的一个理想环境.以往对裸露地区域植物群落演替的研究比较成熟,发现随着暴露年份的增加,植物物种是一个由少变多到稳定的过程[4-7].受植物学研究的影响,冰川前沿裸露地开展的微生物学研究中,常常讨论微生物多样性在暴露年代序列上的变化,并发现裸露地微生物群落演替过程在不同冰川前沿存在着相互矛盾的结果:有的地区细菌多样性随着土壤暴露年份增加而增加[8-10];有的地区恰恰相反[11];还有的地区发现微生物多样性与暴露年份没有明显相关关系[12].

图5 Flavobacterium属和Brevundimonas属在不同年份样品中菌株丰富度变化图中趋势线基于4℃培养时的数据产生
Fig.5 Variations of bacteria abundances of the genera Flavobacteriumand Brevundimonas(The trendlines are based on those cultivated at 4℃)
各地区出现这种各不相同的结果,未必是因采样的偏差或使用的研究手段不同等人为因素所引起的.植物在裸露地存在着从无到有、从零星分布到植被盖度大的过程,其物种多样性随暴露年份增加,是合理可预见的.而微生物群落无论在冰雪中还是冰雪之下都是存在的.裸露地微生物群落在冰川退缩暴露之后,如果粉尘输入或动物传播等途径进入裸露地的微生物能在裸露地建立群落,的确有增加多样性的可能;但同时,因环境改变而使原有微生物种群丧失,也会减少微生物的多少样.因此,在微生物多样性随暴露年份变化出现“相互矛盾的结果”的背后,可能有一个统一的机制:冰川前沿裸露地微生物群落结构发生改变的主要驱动因素是什么.
我们认为:环境因素主导着冰川退缩区微生物群落的分布,是裸露地微生物群落结构发生改变的主要驱动因素,详细内容讨论如下.
本研究发现,在冰土交界处的样品,与暴露1a甚至300多年的样品相比较,微生物的总数差别并不大,对于可培养细菌的数量,25℃下培养的细菌数量随着退缩年龄增加有所增加,但4℃培养的细菌数量却没有这个特点,对比这两个温度下的数据发现:冰土交界处的样品中,在4℃下培养得到的细菌数量比在25℃下的数量要多出20多倍,这一点,与其他样品中在这两个温度下培养获得的细菌数量基本接近的结果有很大差别(图2).联系当地环境,在冰土交界处始终处于相对稳定的低温,而在冰川消融暴露出的地面,温度波动要大得多,生存于其中的微生物群落,有机会经历比冰土交界处更高的温度.当样品置于25℃下培养时,来自冰土交界处的微生物群落受到了从未经历过的高温冲击,在培养基上得到恢复并形成菌落的好氧异养细菌不到4℃下恢复的5%;而暴露过的样品中的微生物群落,已经经历过温度变化的冲击,尽管在多样性和数量上通常还是4℃下恢复的占优,但与25℃下培养结果的差别不是太大.这个差异充分说明环境温度驱动了微生物群落的改变.
环境温度对微生物群落改变的驱动,在两个主要细菌属菌株菌落数量的改变上也有体现.Flavobacterium属和Brevundimonas属细菌在1号冰川前沿植被稀少区域中是优势群落,在冰土交界处,Flavobacterium属的细菌更多,但随着暴露年份的增加,Brevundimonas属细菌逐渐占据的优势地位,这个变化过程大概在10a内完成.虽然所分离到的这两个属的细菌都不是嗜冷菌,但Brevundimonas属的细菌与Flavobacterium属的细菌相比较,来自Flavobacterium属的菌株可能更适应长期稳定的低温环境一些,而来自Brevundimonas属的菌株可能更适应高低温度交替出现的新环境.就这一点差异,暴露后高低温度交替变化的新环境,使微生物群落发生组成结构的变化.
可培养细菌多样性研究结果显示,冰土交界处到暴露了200多年处的好氧异养细菌群落可能是个逐渐变化的过程,Flavobacterium属和Brevundimonas属细菌一直是优势菌群成员(图4和图5).然而在1675年的冰碛垄上,细菌群落发生了比较大的变化,优势菌群变成了来自Bacillus属的细菌.引起这种变化的原因,很可能是环境中营养组成的改变.在1675年的冰碛垄上,植被盖度增加到17%左右,样品的碳氮含量分析结果也显示,此处的营养水平要比暴露时间在此之前的样品高出1倍多(表1).我们知道,异养细菌是一群主要依赖于环境中的营养生存的细菌,当环境中营养水平或一样组成发生改变时,异养细菌群落发生巨大改变是合乎以往认知的.
微生物生物地理学一个主流理论也支持我们认为环境主导着冰川退缩区微生物群落的分布的观点:100a前Bass-Becking等[25]提出,微生物在地球上的扩散没有限制,当地环境选择了适合的种类.因此,环境的不均一性主导了微生物生物地理格局的形成.尽管这个理论也受到挑战,但微生物强大的扩散能力确实受到广泛认可[29],具体到冰川前沿裸露地这么一个小区域内,微生物“种子”的来源更不会有什么大差别,影响退缩路线上微生物群落的分布主要因素最可能就是环境因素.
综上所述,我们认为冰川前沿裸露地中的微生物群落演替是由环境因素主导的一个时空变化过程.以往在裸露地进行的微生物群落变化研究,强调了退缩时间对微生物群落的影响,而缺少对其生存环境的考察,甚至将两个来自完全不同植被盖度下微生物群落进行比较,出现“相互矛盾”的结果就不奇怪了.以后进一步调查冰川前沿裸露地中微生物群落结构时空变化的同时,有针对性的研究相关环境因素,一定能为研究微生物群落的演替提供更深入的见解.
参考文献(References):
[1] Pachauri R K,Reisinger A.Climate Change 2007:Synthesis Report.Contribution of Working Groups I,II and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change[M].Geneva,Switzerland:IPCC,2007:1-104.
[2] Chen Yong,Zhou Lihua,Sun Xike.The adaptation countermeasures to glacier shrinkage in some typical counties of Tibetan Autonomous Region[J].Journal of Glaciology and Geocryology,2011,33(1):205-213.[陈勇,周立华,孙希科.青藏高原典型县域冰川退化情景下的适应对策研究[J].冰川冻土,2011,33(1):205-213.]
[3] Yue Jun,Liu Guangxiu,Zhang Gaosen,etal.Changes in soil properties and culturable bacteria diversity in Zhadang Glacier foreland[J].Journal of Glaciology and Geocryology,2010,32(6):1180-1185.[岳君,刘光琇,章高森,等.念青唐古拉山扎当冰川退缩前沿土壤性质与可培养细菌多样性变化[J].冰川冻土,2010,32(6):1180-1185.]
[4] Hodkinson I D,Coulson S J,Webb N R.Community assembly along proglacial chronosequences in the high Arctic:vege-tation and soil development in north-west Svalbard[J].Journal of Ecology,2003,91(4):651-663.
[5] Huston M,Smith T.Plant succession:life history and competition[J].American Naturalist,1987,130(2):168-198.
[6] Matthews J A.The Ecology of Recently Deglaciated Terrain:A Geoecological Approach to Glacier Forelands and Primary Succession[M].New York,NY:Cambridge University Press,1992.
[7] Walker LR,del Moral R.Primary Succession and Ecosystem Rehabilitation[M].New York,NY:Cambridge University Press,2003.
[8] Nemergut D R,Anderson S P,Cleveland C C,etal.Microbial community succession in an unvegetated,recently deglaciated soil[J].Microbial Ecology,2007,53(1):110 122.
[9] Sch tte U M E,Abdo Z,Foster J,etal.Bacterial diversity in a glacier foreland of the high Arctic[J].Molecular Ecology,2010,19:54-66.
[10]Wu X,Zhang W,Liu G,etal.Bacterial diversity in the foreland of the Tianshan No.1Glacier China[J].Environmental Research Letters,2012,7:014038.
[11]Sigler W V,Crivii S,Zeyer J.Bacterial succession in glacial forefield soils characterized by community structure,activity and opportunistic growth dynamics[J].Microbial Ecology,2002,44(4):306-316.
[12]Zumsteg A,Luster J,G ransson H,etal.Bacterial,archaeal and fungal succession in the forefield of a receding glacier[J].Microbial Ecology,2012,63(3):552-564.
[13]Zhang W,Zhang G,Liu G,etal.Diversity of bacterial communities in the snow cover at Tianshan Number 1Glacier and its relation to climate and environment[J].Geomicrobiology,2012,29(5):459-469.
[14]Zhang Wei,Zhang Gaosen,Liu Guangxiu,etal.Diversity and its temporal-spatial characteristics of eukaryotic microorganisms on Glacier No.1at theÜrümqi River Head,Tianshan Mountains[J].Journal of Glaciology and Geocryology,2011,32(5):906-913.[张威,章高森,刘光琇,等.天山乌鲁木齐河源1号冰川中真核微生物多样性分布及时空变化研究[J].冰川冻土,2011,32(5):906-913.]
[15]Schallenberg M,Kalff J,Rasmussen J B.Solutions to problems in enumberating sediment bacteria by direct counts[J].Applied and Environmental Microbiology,1989,55:1214-1219.
[16]Staley J T.Prosthecomicrobium and Ancalomicrobium:new prosthecate freshwater bacteria[J].Journal of Bacteriology,1968,95:1921-1942.
[17]Lane D J.16S/23SrRNA sequencing[M]//Stackebrandt E,Goodfellow M.Nucleic Acid Techniques in Bacterial Systematics.New York:Willey,1991:115-148.
[18]Zhang G,Ma X,Niu F,etal.Diversity and distribution of alkaliphilic psychrotolerant bacteria in the Qinghai-Tibet Plateau permafrost region[J].Extremophiles,2007,11(3):415-424.
[19]Huber T,Faulkner G,Hugenholtz P.Bellerophon;aprogram to detect chimeric sequences in multiple sequence alignments[J].Bioinformatics,2004,20(14):2317-2319.
[20]Altschul S F,Gish W,Miller W,etal.Basic local alignment search tool[J].Journal of Molecular Biology,1990,215:403-410.
[21]Larkin M A,Blackshields G,Brown N P,etal.Clustal W and clustal X version 2.0[J].Bioinformatics,2007,23:2947-2948.
[22]Saitou N,Nei M.The Neighbor-joining method a new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4(4):406-425.
[23]Tamura K,Peterson D,Peterson N,etal.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28:2731-2739.
[24]Felsenstein J.Confidence-Limits on phylogenies-an approach using the bootstrap[J].Evolution,1985,39:783-791.
[25]Baas-Becking L G M.Geobiologie of Inleiding Tot De Milieukunde[M].The Hague,the Netherlands:W.P.Van Stock-um &Zoon(in Dutch),1934.
[26]Friedmann E I.Permafrost as microbial habitat[M]//Gilinchisky DA.Viable Microorganisms in Permafrost.Pushchino:Institute of Soil Science and Photosynthesis,Russian A-cademy of Science,1994:21-26
[27]Gilichinsky D A,Wagener S.Microbial life in permafrost:a historical review[J].Permafrost Periglacial Processes,1995,6(3):234-250.
[28]Zhang G,Niu F,Ma X,etal.Phylogenetic diversity of bacteria isolates from the Qinghai-Tibet Plateau permafrost region[J].Canadian Journal of Microbiology,2007,53(8):1000-1010.
[29]Finlay B,Clarke K.Ubiquitous dispersal of microbial species[J].Nature,1999,400:828
Distribution of Aerobic Heterotrophic Bacteria Managed by Environmental Factors in Glacier Foreland
Abstract:Glacier foreland,possessing a chronosequence of exposure,is an ideal area to study microbial community dynamics across space and time.Traditional microbial study in the foreland of the east branch of the Glacier No.1showed the number of culturable bacteria at 25℃increasing from 5.5×104 CFUs·g-1 at the edge of glacier terminus to 3.3×106 CFUs·g-1 at the moraine of 1675.In contrast,there is no significant correlation between the number of culturable bacteria or total microorganisms and the chronosequence.There were two stages of major change in bacterial population:1)at the beginning of exposure and 2)at the stage of distinctly increasing vegetation coverage.Consequently,these two stages reflected the change in environmental temperature and the enhancement in soil nutrient level.The results indicate that the change in environment drives the change in microbial community spatially and temporally.
Key words:glacier foreland;microorganism;microbial community succession;environmental factors
中图分类号:Q938
文献标识码:A
文章编号:1000-0240(2012)04-0965-07
收稿日期:2012-01-08;
修订日期:2012-05-30
基金项目:国家自然科学基金项目(40971034;31170465;31100365);国家重点基础研究发展计划(973计划)项目(2012CB026105);国家国际科技合作专项项目(2011DFA32520)资助
