冰川前沿裸露地微生物生态学研究进展
【类型】期刊
【作者】伍修锟,毛文梁,台喜生,张威,刘光琇,陈拓,龙昊知,张宝贵,陈年来(中国科学院寒区旱区环境与工程研究所沙漠与沙漠化重点实验室;甘肃农业大学资源与环境学院)
【作者单位】中国科学院寒区旱区环境与工程研究所沙漠与沙漠化重点实验室;甘肃农业大学资源与环境学院
【刊名】冰川冻土
【关键词】 冰川前沿;微生物生态;研究进展
【资助项】...;国家自然科学基金项目 (31170465;40971034);国家自然科学基础人才培养基金冰川学冻土学特殊学科点 (J1210003/J0109)
【ISSN号】1000-0240
【页码】P217-223
【年份】2019
【期号】第1期
【期刊卷】1;|7;|8;|2
【摘要】微生物对冰川前沿裸露地土壤的发育具有影响,并且参与生物地球化学循环,在后续生物的定居和生长过程中起着重要作用.近100多年来,全球气候持续变暖,平均温度升高了约0.74℃.在气候变暖的影响下,全球冰川快速退缩,研究冰川前沿裸露地微生物的原生演替成为当前热点研究领域.文章系统综述了冰川前沿裸露地微生物的群落结构和数量变化规律、微生物对土壤发育和改良的作用及N循环相关微生物群落结构的变化及其作用,旨在探索其演替规律,为确定微生物在冰川前沿这一特殊生境中的生态功能奠定理论基础.
【全文】 文献传递
冰川前沿裸露地微生物生态学研究进展
摘 要:微生物对冰川前沿裸露地土壤的发育具有影响,并且参与生物地球化学循环,在后续生物的定居和生长过程中起着重要作用.近100多年来,全球气候持续变暖,平均温度升高了约0.74℃.在气候变暖的影响下,全球冰川快速退缩,研究冰川前沿裸露地微生物的原生演替成为当前热点研究领域.文章系统综述了冰川前沿裸露地微生物的群落结构和数量变化规律、微生物对土壤发育和改良的作用及N循环相关微生物群落结构的变化及其作用,旨在探索其演替规律,为确定微生物在冰川前沿这一特殊生境中的生态功能奠定理论基础.
关键词:冰川前沿;微生物生态;研究进展
0 引言
近100多年来,全球气候持续变暖,平均温度升高了约0.74℃[1],在气候变暖的影响下,世界上大多数的冰川开始退缩,不仅极地冰盖的消融日渐增强,山地冰川和冰帽的消融也进一步加剧[2].冰川退缩后暴露的土地称为原生裸露地,这种新暴露出的原生裸露地因营养匮乏无植物生长,且受人为干扰较少,为研究生物的原生演替提供了一个天然而独特的环境.微生物是冰川退缩后最先寄居的生物,在原生演替过程中发挥了重要的生态学功能,在促进土壤的发育成熟、参与生物地球化学循环以及后续生物的定居和生长过程中起了重要作用,因此对它的研究具有重要的生态学意义[3].目前,研究地区有:阿尔卑斯山(Damma Glacier、Rotmoofemer Glacier、Ödenwinkelkees Glacier、Tsanfleuron Glacier、Morteratsh Glacier)、高北极地区(Mittivakkat Glacier、Ellesmere Island Glacier、Arklio Glacier、Blåisen Glacier、Austre Brøggerbreen、Mendenhall Glacier)、北 美 洲(Athabasca Glacier、Lyman Glacier)、安第斯山脉(Puca Glacier)、南极洲(Anvers Island Glaicer)和高亚洲地区(天山乌鲁木齐河源1号冰川、冬克玛底冰川、扎当冰川)等,其中对阿尔卑斯山和高北极地区的研究较多,其他地区较少,分布见图1.在此类环境系统中,对于植物和动物的演替已经有了广泛的研究[4-7],而对微生物的研究相对较少[8].因此,对冰川前沿裸露地微生物的研究现状进行综述总结是非常必要和重要的.
1 冰川前沿裸露地微生物数量、群落结构特征及演替规律
1.1 细菌数量、群落结构特征及演替规律
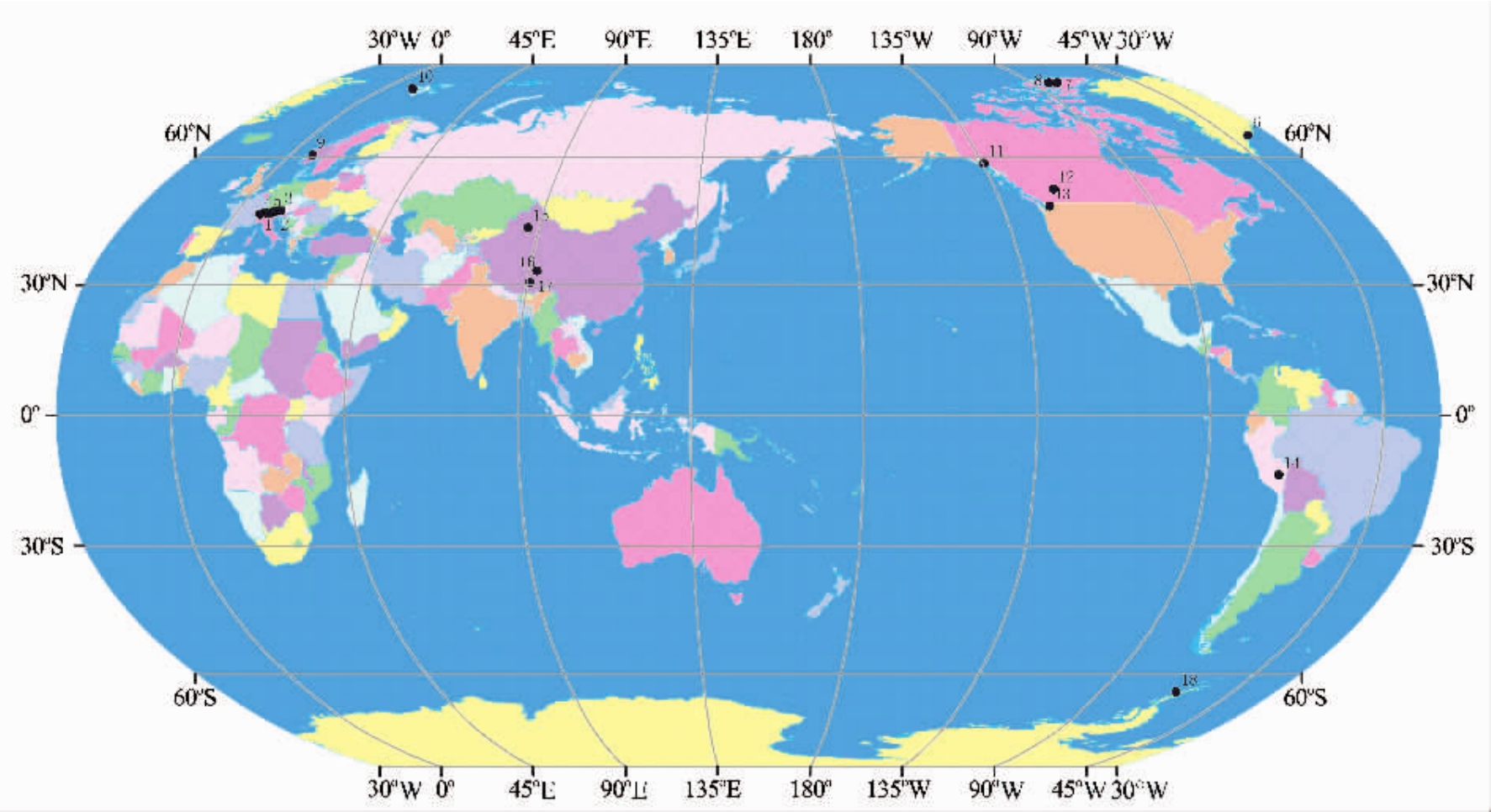
图1 全球冰川前沿微生物生态研究分布图
Fig.1 The study sites of microbial ecology in the glacier foreland all over the world
1.Damma Glacier;2.Rotmoosferner Glacier;3.Ödenwinkelkees Glacier;4.Tsanfleuron Glacier;5.Morteratsch Glacier;6.Mittivakkat Glacier;7.Ellesmere Island Glacier;8.Arklio Glacier;9.Blåisen Glacier;10.Austre Brøggerbreen Glacier;11.Mendenhall Glacier;12.Athabasca Glacier;13.Lyman Glacier;14.Puca Glacier;15.天山乌鲁木齐河源1号冰川;16.冬克玛底冰川;17.扎当冰川;18.Anvers Island Glaicer
Sigler等[9]采用DAPI荧光染料计数的方法,研究了Rotfirnglacier和Damma冰川前沿细菌的数量,结果显示:Damma冰川前沿细菌的数量在8.21×107~1.49×109 cells·g-1dw之间,且细菌数量随冰川退缩时间呈上升趋势,但Rotfirnglacier冰川前沿细菌数量变化并非如此,而是呈现先上升后下降的趋势,数量从1.13×108 cells·g-1dw上升到1.9×109 cells·g-1dw而后下降到5.93×108 cells·g-1dw.岳君等[10]对念青唐古拉山扎当冰川退缩前沿土壤中可培养细菌的研究显示,可培养细菌的数量为104~105 CFU·g-1,与冰川退缩时间没有相关性.冬克玛底冰川可培养细菌数量介于3.00×104~4.11×105 CFU·g-1之间,且随冰川退缩时间呈上升趋势并与之显著相关[11].在对天山乌鲁木齐河源1号冰川(以下简称1号冰川)的研究中也得到了同样的结论,可培养细菌数介于5.5×104~3.3×106CFU·g-1之间,高于冬克玛底和扎当冰川[12].以上研究表明,虽然冰川前沿环境恶劣(如寡营养、低温、高辐射等),但仍然有大量微生物存在,且数量均随冰川退缩时间呈现上升趋势.
不仅细菌的数量随着冰川退缩时间发生改变,其多样性也在变化.Sigler等[13]对Damma冰川前沿细菌群落多样性进行了研究,结果显示:不仅主要的细菌群落多样性随冰川退缩时间呈下降趋势,均匀度指数也呈下降趋势.Nemergut等[14]对安第斯山脉Puca冰川前沿细菌群落多样性的研究显示,细菌群落多样性和均匀度指数均随冰川退缩时间呈上升趋势.Schütte等[15]采用高通量测序的方法研究了高北极地区冰川前沿裸露地细菌群落结构的变化规律,发现在整个演替过程中,细菌群落的均匀度指数呈逐渐上升趋势,演替指数非常高并随演替时间呈下降趋势.在1号冰川的研究中得到了更高的演替指数,其细菌Shannon多样性指数在演替过程中也呈上升趋势[16].虽然大部分的研究结果表明细菌群落的多样性随冰川退缩时间呈上升趋势,但也有研究得出相反结论,导致相反结论的原因可能是冰川的地理格局差异以及气候因素[12],同时也说明细菌群落多样性演替变化规律还需要进一步的研究.
冰川前沿裸露地主要的细菌群落各有不同.Foght等[17]对新西兰南阿尔卑斯山的Fox和Franz Josef冰川前沿裸露地的研究发现,可培养细菌主要分为α-变形菌门、β-变形菌门、放线菌门、拟杆菌门、厚壁菌门和栖热菌门,其中以β-变形菌门为主.而在喜马拉雅山脉Pindari冰川前沿裸露地[18],可培养细菌分属于变形菌门、放线菌门、拟杆菌门和厚壁菌门,其中以放线菌门和厚壁菌门为主.岳君等[10]在青藏高原扎当冰川前沿裸露地的研究中得到了5大类群的可培养细菌,以放线菌门、拟杆菌门和α-变形菌门为主.Schütte等[15]对高北极地区冰川前沿细菌群落结构进行高通量分析,发现了丰富的细菌含量,可归类为20个菌门;对1号冰川前沿细菌群落进行高通量分析后,共发现31个菌门[16],其中有19个菌门为共有菌,其余的为各地所特有.冬克玛底冰川454高通量测序共发现32个菌门,与1号冰川相比较,有27个菌门为共有,其中以变形菌门、放线菌门、拟杆菌门和酸杆菌门为优势种群.以上研究结果说明,在冰川前沿裸露地中变形菌门、放线菌门、拟杆菌门为常见的细菌群落.变形菌包括很多光能自养、光能异养和化能无机营养菌,非常适合在寡营养的生境中生存.放线菌中有很多都能形成孢子或菌丝,菌丝可以扩大细菌获得营养和水分的范围,从而适应极端环境而大量存活.拟杆菌菌群由于具有适应寡营养的能力成为早期裸露土壤中微生物菌群的主要组成部分,并且拟杆菌菌群具有分解高分子量有机物的能力,这意味着拟杆菌菌群可以在养分缺乏的早期裸露土壤中通过降解环境中的有机物为微生物提供碳源和能源.综上所述,各冰川前沿裸露地中相似菌群可能是由菌群性质决定的,而不同菌群可能是由于地理差异造成的[12].
1.2 真菌和古菌的数量、群落结构特征及其演替规律
不仅细菌的数量和多样性随冰川退缩时间不断的发生演变,土壤中真菌和古菌的数量及多样性也在发生着变化.Fujiyoshi等[19]研究了高北极地区Austre Brøggerbreen冰川前沿裸露地中菌根真菌的演替规律,结果表明:菌根真菌的数量和多样性都是随冰川退缩时间呈上升趋势,且在演替后期外生菌根真菌的多样性最高.菌根真菌菌丝体能够使寄主植物从土壤中获得更多的养分,改善寄主植物种子发芽和生长条件[20],因此,菌根真菌对冰川前沿植物的原生演替具有重要的生态学作用.Blaalid等[21]采用高通量测序方法研究了Blåisen冰川前沿裸露地中的真菌,结果显示其多样性很高,虽然分布呈高异质性[22],但其数量和多样性的整体变化规律都是随冰川退缩时间呈上升趋势;Oehl等[23]在对Morteratsch冰川前沿菌根真菌的研究中也得到了同样结论.
Zumsteg等[24]采用末端限制性片段长度多态性和克隆文库分析方法,研究了Damma冰川前沿裸露地中古菌和真菌的演替规律,结果显示:泉古菌所占百分比随土壤暴露时间的增加而增加,在演替初期优势菌群为广古菌,后期为泉古菌.土壤中的真菌主要由担子菌门和子囊菌门组成,在演替初期子囊菌门为优势菌,后期担子菌门为优势菌.其原因可能是在冰川演替初期,寡营养类型的古菌和真菌占主要地位,而到了演替后期植被出现,适合富营养的古菌和真菌则占据了主要地位.Nicol等[25]采用DGGE的方法研究了Rotmoosferner冰川前沿土壤中古菌的演替过程,发现早期优势种群为非嗜热泉古菌,中期为常温泉古菌.
冰川前沿裸露地中真菌的一般变化规律是数量和多样性均随冰川退缩时间呈上升趋势,且与冰川前沿植被关系密切.相较于真菌和细菌,对古菌的研究较少[25],其变化规律还有待进一步探索.
2 微生物与土壤理化因子的关系
2.1 微生物与土壤C、N的关系
冰川前沿土壤营养贫瘠,C、N含量很低,是微生物和植物生长的限制性因素.微生物是演替过程中最先寄居的生物,在演替过程中促进土壤发育,增加土壤中的C、N含量,在后续生物的定居和生长过程中起重要作用.
Yoshitake等[26]用磷脂脂肪酸分析(PFLA)的方法研究了加拿大高北极冰川的微生物演替,发现随演替时间的增加,微生物生物量与土壤C、N(有机质)含量呈正相关.王晓霞等[27]采用同样的方法研究了1号冰川前沿裸露地微生物生物量与土壤C、N含量的关系,结果表明虽然二者随演替时间呈波动状,不同于Damma冰川前沿微生物生物量持续增加[9],但微生物生物量与土壤C、N含量呈极显著正相关,与极地冰川前沿裸露地微生物的研究结果相似[28].在冬克玛底冰川前沿裸露地土壤的研究中,可培养细菌数量与土壤C、N含量也呈极显著正相关[11].Kaštovská等[29]对北极的冰川前沿裸露地土壤的理化性质和细菌多样性进行了研究,发现N含量是影响细菌多样性的主要因素.以上研究说明,冰川前沿裸露地中土壤C、N含量与土壤微生物密切相关,同时细菌的生长状态也可以作为反映冰川前沿土壤营养状态的指标[30].
2.2 微生物与土壤pH值的关系
土壤的pH值能影响土壤中C的矿化速率,在土壤微生物多样性中起着重要作用[31].土壤pH值主要由有机酸含量决定,研究表明少量的有机酸通过大气沉降进入土壤,大部分则来源于土壤微生物的释放和根分泌物的溶解[32].
Männistö等[33]对北极Finnish Lapland地区的细菌群落多样性进行了研究,发现土壤pH值是影响细菌群落结构的主要因素:土壤pH值在4.6~5.2时,酸杆菌门(Acidobacteria)为优势菌群;当pH值大于5.5时,酸杆菌门细菌数量降低.在研究南极Alexander Island地区的细菌群落结构时发现,土壤pH值与细菌群落结构之间存在显著相关性,当pH值较低时,酸杆菌门为优势菌群[34].冬克玛底冰川前沿裸露地土壤中可培养细菌数与土壤pH值也是呈显著负相关的[11].这些研究表明,土壤微生物对土壤pH值有改良作用,同时,土壤pH值也影响着冰川前沿裸露地微生物的数量和种类.
2.3 微生物与土壤酶活性的关系
土壤酶主要来源于微生物、土壤动物、植物根系以及植物残体,冰川前沿裸露地由于环境条件恶劣、土壤贫瘠,土壤酶以土壤微生物分泌的酶为主要来源[35],同时土壤酶活性能够反映出土壤微生物的群落代谢和营养供给[36].
Tscherko等[37]测定了奥地利 Rotmoosferner和Ödenwinkelkees冰川前沿裸露地土壤酶活性和微生物的变化规律,发现随着土壤微生物原生演替的进行,其酶活性的Shannon多样性指数呈持续性增长,并于演替中期(50a)达到稳定状态.王晓霞等[27]测定了1号冰川前沿土壤酶活性及微生物生物量的变化规律,结果显示:在43a的演替过程中,其前沿微生物多样性和土壤酶活性都随时间推移而增加,但并未达到稳定状态.Liu等[11]对冬克玛底冰川前沿可培养微生物数量及种类与土壤酶活性关系的研究结果表明,可培养细菌数量不仅与脲酶、蔗糖酶、多酚氧化酶、过氧化氢酶和脱氢酶活性呈极显著正相关,而且与放线菌、γ-变形菌、拟杆菌和厚壁菌的数量具有相关性,同时随着冰川退缩时间的推移呈上升趋势.综上所述,冰川前沿裸露地土壤酶活性与土壤微生物具有密切的相关性,并且可以作为冰川前沿土壤微生物生长和活性的指标.
3 N循环相关功能微生物的演替规律
N是生态系统发展的一个限制性因素.固氮微生物在冰川前沿这种环境中通常作为先锋微生物并发挥固氮作用[38],随着时间的推移再让位给其他物种.固氮微生物被证明与土壤N的累积密切相关,土壤中可用N的增加为后来演替物种提供了有利条件[39].研究冰川前沿这种特殊生境中固氮菌和氨氧化菌更有助于了解环境因素对冰川前沿氮循环功能菌的影响,以及冰川前沿N循环在全球N循环中发挥的作用.
Schmidt等[40]用生物地球化学和分子生物学技术相结合的方法,研究了安第斯山脉高海拔Puca冰川前沿的微生物群落,发现在冰川退缩的4~5a内,蓝细菌就定居于退缩的土壤中,并且蓝细菌的多样性及相应的土壤稳定性、异养微生物生物量、土壤酶活性都显著增加.在苔藓、地衣以及维管束植物定植前,固氮速率较演替的前4~5a增加了两个数量级.Duc等[41]采用克隆文库的方法研究了Damma冰川前沿固氮菌的多样性,结果显示其多样性非常丰富,所得固氮菌和类似环境中的固氮菌遗传距离很近,说明固氮菌对氮缺乏环境中的氮输入具有重要作用[38,42].Deiglmayr等[43]提取阿尔卑斯中部冰川前沿早熟禾的根际土壤总DNA,对其中的硝酸盐还原酶基因进行扩增并进行限制性片段长度多态性(RFLP)分析,发现硝酸盐还原细菌的多样性在演替中、后期逐渐降低.Kandeler等[44]采用定量PCR的方法研究Rotmoosferner冰川前沿反硝化功能基因nirG、nirS、nirK和nosZ数量的变换规律,发现nirG和nirS基因数量在演替早期占优势,演替后期以nirK和nosZ基因为主,说明反硝化菌在冰川退缩过程中是不断演替的.
土壤pH值是影响氨氧化菌群落结构的一个重要因素,这是由于土壤pH值决定着土壤中氨的存在形式,当pH值较低时,氨(NH3)会转变成铵(NH+4),影响氨氧化菌对底物NH3的获得,从而影响氨氧化菌的活性和丰度甚至种类[45-46].此外,海拔也会影响氨氧化菌的群落结构,例如,Zhang等[47]采集了珠穆朗玛峰北坡海拔在4000~6550m的12个土样,运用定量PCR和克隆文库的方法研究了氨氧化古菌、细菌的丰度和分布变化规律,结果发现当海拔小于5400m时,氨氧化古菌的丰度大于氨氧化细菌的丰度;当海拔大于5700m时则相反.氨氧化古菌和细菌的丰度都随着海拔升高而迅速降低,说明氨氧化古菌和细菌的丰度以及群落结构的变化是由于海拔环境对微生物的选择作用造成的.
4 展望
冰川前沿裸露地是一个寡营养、低温、高辐射的极端环境,但微生物依然大量存在,并发挥着风化岩石[18]、促进土壤发育及土壤物质累积和改良作用,为后续的动植物演替提供物质基础.通过研究微生物的原生演替,能够揭示微生物数量和种类以及功能的变化规律.通过对冰川前沿土壤理化性质的变化以及微生物对土壤性质影响的研究,探讨微生物在原生演替中的作用,揭示土壤发育过程,阐述微生物在改造土壤方面的作用,能够为退化土地的微生物修复提供理论基础.
中国拥有丰富的冰川类型,包括大陆性冰川、亚大陆冰川和海洋型冰川,且冰川分布的范围广,从低纬度到高纬度地区都有分布[48-49].而国内对冰川前沿裸露地微生物演替的研究还很少[50],对微生物群落结构和相关功能微生物(N循环和岩石风化等)的演替规律报道较少,不同类型冰川前沿裸露地微生物演替的异同及同种类型不同地理位置冰川前沿裸露地微生物演替的异同还未见报道,可以预见冰川前沿裸露地微生物演替的研究,将成为国内微生物生态学发展的重要方向之一.
参考文献(References):
[1]Pachauri R K,Reisinger A.Climate Change 2007:Synthesis Report.Contribution of Working GroupsⅠ,ⅡandⅢto the Fourth Assessment Report of the Intergovernmental Panel on Climate Change[R].Geneva,Switzerland:IPCC,2008:1-104.
[2]Kintisch E.Global warming:Projections of climate change go from bad to worse,scientists report[J].Science,2009,323(5921):1546-1547.
[3]Philippot L,Tscherko D,Bru D,et al.Distribution of high bacterial taxa across the chronosequence of two alpine glacier forelands[J].Microbial Ecology,2011,61(2):303-312.
[4]Caccianiga M,Andreis C.Pioneer herbaceous vegetation on glacier forelands in the Italian Alps[J].Phytocoenologia,2004,34(1):55-89.
[5]Hodkinson I D,Coulson S J,Webb N R.Invertebrate community assembly along proglacial chronosequences in the high Arctic[J].Journal of Animal Ecology,2004,73(3):556-568.
[6]Frenot Y,Gloaguen J C,Cannavacciuolo M,et al.Primary succession on glacier forelands in the subantarctic Kerguelen Islands[J].Journal of Vegetation Science,1998,9(1):75-84.
[7]del Moral R,Wood D M.Early primary succession on the volcano Mount St.Helens[J].Journal of Vegetation Science,1993,4(2):223-234.
[8]Schütte U M E,Abdo Z,Bent S J,et al.Bacterial succession in a glacier foreland of the High Arctic[J].The ISME Journal,2009,3(11):1258-1268.
[9]Sigler W V,Zeyer J.Microbial diversity and activity along the forefields of two receding glaciers[J].Microbial Ecology,2002,43(4):397-407.
[10]Yue Jun,Liu Guangxiu,Zhang Gaosen,et al.Changes in soil properties and culturable bacteria diversity in Zhadang Glacier foreland[J].Journal of Glaciology and Geocryology,2010,32(6):1180-1185.[岳君,刘光琇,章高森,等.念青唐古拉山扎当冰川退缩前沿土壤性质与可培养细菌多样性变化[J].冰川冻土,2010,32(6):1180-1185.]
[11]Liu G X,Hu P,Zhang W,et al.Variations in soil culturable bacteria communities and biochemical characteristics in the Dongkemadi glacier forefield along a chronosequence[J].Folia Microbiologica,2012,57(6):485-494.
[12]Zhang Gaosen,Zhang Wei,Liu Guangxiu,et al.Distribution of aerobic heterotrophic bacteria managed by environment factors in glacier foreland[J].Journal of Glaciology and Geocryology,2012,34(4):965-971.[章高森,张威,刘光琇,等.环境因素主导着冰川前沿裸露地好氧异养细菌群落的分布[J].冰川冻土,2012,34(4):965-971.]
[13]Sigler W V,Crivii S,Zeyer J.Bacterial succession in glacial forefield soils characterized by community structure,activity and opportunistic growth dynamics[J].Microbial Ecology,2002,44(4):306-316.
[14]Nemergut D R,Anderson S P,Cleveland C C,et al.Microbial community succession in an unvegetated,recently deglaciated soil[J].Microbial Ecology,2007,53(1):110-122.
[15]Schütte U M E,Abdo Z,Foster J,et al.Bacterial diversity in a glacier foreland of the high Arctic[J].Molecular Ecology,2010,19(S1):54-66.
[16]Wu X,Zhang W,Liu G,et al.Bacterial diversity in the foreland of the Tianshan No.1glacier,China[J].Environmental Research Letters,2012,7(1),doi:10.1088/1748-9326/7/1/014038.
[17]Foght J,Aislabie J,Turner S,et al.Culturable bacteria in subglacial sediments and ice from two Southern Hemisphere glaciers[J].Microbial Ecology,2004,47(4):329-340.
[18]Shivaji S,Pratibha M S,Sailaja B,et al.Bacterial diversity of soil in the vicinity of Pindari glacier,Himalayan mountain ranges,India,using culturable bacteria and soil 16SrRNA gene clones[J].Extremophiles,2011,15(1):1-22.
[19]Fujiyoshi M,Yoshitake S,Watanabe K,et al.Successional changes in ectomycorrhizal fungi associated with the polar willowSalix polaris in a deglaciated area in the High Arctic,Svalbard[J].Polar Biology,2011,34(5):667-673.
[20]Nara K.Ectomycorrhizal networks and seedling establishment during early primary succession[J].New Phytologist,2006,169(1):169-178.
[21]Blaalid R,Carlsen T,Kumar S,et al.Changes in the rootassociated fungal communities along aprimary succession gradient analysed by 454pyrosequencing[J].Molecular Ecology,2012,21(8):1897-1908.
[22]Jumpponen A.Soil fungal community assembly in a primary successional glacier forefront ecosystem as inferred from rDNA sequence analyses[J].New Phytologist,2003,158(3):569-578.
[23]Oehl F,Schneider D,Sieverding E,et al.Succession of arbuscular mycorrhizal communities in the foreland of the retreating Morteratsch glacier in the Central Alps[J].Pedobiologia,2011,54(5-6):321-331.
[24]Zumsteg A,Luster J,Göransson H,et al.Bacterial,archaeal and fungal succession in the forefield of a receding glacier[J].Microbial Ecology,2012,63(3):552-564.
[25]Nicol G W,Tscherko D,Embley T M,et al.Primary succession of soil Crenarchaeota across a receding glacier foreland[J].Environmental Microbiology,2005,7(3):337-347.
[26]Yoshitake S,Uchida M,Nakatsubo T,et al.Characterization of soil microflora on a successional glacier foreland in the high Arctic on Ellesmere Island,Nunavut,Canada using phospholipid fatty acid analysis[J].Polar Bioscience,2006,19:73-84.
[27]Wang Xiaoxia,Zhang Tao,Sun Jian,et al.Ecological characterization of soil microflora in primary succession across glacier forefield:a case study of Glacier No.1at the headwaters ofÜrümqi River[J].Acta Ecologica Sinica,2010,30(23):6563-6570.[王晓霞,张涛,孙建,等.冰川前缘土壤微生物原生演替的生态特征——以乌鲁木齐河源1号冰川为例[J].生态学报,2010,30(23):6563-6570.]
[28]Bekku Y,Kume A,Nakatsubo T,et al.Microbial biomass in relation to primary succession on Arctic deglaciated moraines[J].Polar Bioscience,1999,12:47-53.
[29]KaštovskáK,Elster J,Stibal M,et al.Microbial assemblages in soil microbial succession after glacial retreat in Svalbard(high Arctic)[J].Microbial Ecology,2005,50(3):396-407.
[30]Göransson H,Olde Venterink H,Bååth E.Soil bacterial growth and nutrient limitation along a chronosequence from a glacier forefield[J].Soil Biology and Biochemistry,2011,43(6):1333-1340.
[31]Jangid K,Williams M A,Franzluebbers A J,et al.Relative impacts of land-use,management intensity and fertilization upon soil microbial community structure in agricultural systems[J].Soil Biology and Biochemistry,2008,40(11):2843-2853.
[32]Millet M,Wortham H,Sanusi A,et al.Low molecular weight organic acids in fogwater in an urban area:Strasbourg(France)[J].Science of the Total Environment,1997,206(1):57-65.
[33]MännistöM K,Tiirola M,Häggblom M M.Bacterial communities in Arctic fjelds of Finnish Lapland are stable but highly pH-dependent [J].FEMS Microbiology Ecology,2007,59(2):452-465.
[34]Chong C W,Convey P,Pearce D A,et al.Assessment of soil bacterial communities on Alexander Island(in the maritime and continental Antarctic transitional zone)[J].Polar Biology,2012,35(3):387-399.
[35]Zhang Yongmei,Zhou Guoyi,Wu Ning.A review of studies on soil enzymology[J].Journal of Tropical and Subtropical Botany,2004,12(1):83-90.[张咏梅,周国逸,吴宁.土壤酶学的研究进展[J].热带亚热带植物学报,2004,12(1):83-90.]
[36]Caldwell B A.Enzyme activities as a component of soil biodiversity:A review[J].Pedobiologia,2005,49(6):637-644.
[37]Tscherko D,Rustemeier J,Richter A,et al.Functional diversity of the soil microflora in primary succession across two glacier forelands in the Central Alps[J].European Journal of Soil Science,2003,54(4):685-696.
[38]Strauss S L,Garcia-Pichel F,Day T A.Soil microbial carbon and nitrogen transformations at a glacial foreland on Anvers Island,Antarctic Peninsula[J].Polar Biology,2012,35(10):1459-1471.
[39]Chapin F S,Walker L R,Fastie C L,et al.Mechanisms of primary succession following deglaciation at Glacier Bay,Alaska[J].Ecological Monographs,1994,64(2):149-175.
[40]Schmidt S K,Reed S C,Nemergut D R,et al.The earliest stages of ecosystem succession in high-elevation(5000metres above sea level),recently deglaciated soils[J].Proceedings of the Royal Society B:Biological Sciences,2008,275(1653):2793-2802.
[41]Duc L,Noll M,Meier B E,et al.High diversity of diazotrophs in the forefield of a receding alpine glacier[J].Microbial Ecology,2009,57(1):179-190.
[42]Brankatschk R,Töwe S,Kleineidam K,et al.Abundances and potential activities of nitrogen cycling microbial communities along a chronosequence of a glacier forefield[J].The ISME Journal,2011,5(6):1025-1037.
[43]Deiglmayr K,Philippot L,Tscherko D,et al.Microbial succession of nitrate-reducing bacteria in the rhizosphere of Poa alpina across a glacier foreland in the Central Alps[J].Environmental Microbiology,2006,8(9):1600-1612.
[44]Kandeler E,Deiglmayr K,Tscherko D,et al.Abundance of narG,nirS,nirK,and nosZ Genes of denitrifying bacteria during primary successions of a glacier foreland[J].Applied and Environmental Microbiology,2006,72(9):5957-5962.
[45]HöfferleŠ,Nicol G W,Pal L,et al.Ammonium supply rate influences archaeal and bacterial ammonia oxidizers in a wetland soil vertical profile[J].FEMS Microbiology Ecology,2010,74(2):302-315.
[46]Nicol G W,Leininger S,Schleper C,et al.The influence of soil pH on the diversity,abundance and transcriptional activity of ammonia oxidizing archaea and bacteria[J].Environmental Microbiology,2008,10(11):2966-2978.
[47]Zhang L M,Wang M,Prosser J I,et al.Altitude ammoniaoxidizing bacteria and archaea in soils of Mount Everest[J].FEMS Microbiology Ecology,2009,70(2):208-217.
[48]Zhang Guofei,Li Zhongqin,Wang Wenbin,et al.Change processes and characteristics of mass balance of theÜrümqi Glacier No.1at the headwaters of theÜrümqi River,Tianshan Mountains,during 1959-2009[J].Journal of Glaciology and Geocryology,2012,34(6):1301-1309.[张国飞,李忠勤,王文彬,等.天山乌鲁木齐河源1号冰川1959-2009年物质平衡变化过程及特征研究[J].冰川冻土,2012,34(6):1301-1309.]
[49]Sun Weijun,Qin Xiang,Ren Jiawen,et al.Surface energy balance in the accumulation zone of the Laohugou Glacier No.12in the Qilian Mountains during ablation period[J].Journal of Glaciology and Geocryology,2011,33(1):38-46.[孙维君,秦翔,任贾文,等.祁连山老虎沟12号冰川积累区消融期能量平衡特征[J].冰川冻土,2011,33(1):38-46.]
[50]Hu Ping,Wu Xiukun,Li Shiweng,et al.Progress of studies on permafrost microbial ecology in the past 10years [J].Journal of Glaciology and Geocryology,2012,34(3):732-739.[胡平,伍修锟,李师翁,等.近10a来冻土微生物生态学研究进展[J].冰川冻土,2012,34(3):732-739.]
Progress in Studies of Microbial Ecology in Glacier Foreland
Abstract:Microorganisms in the glacier foreland can promote the soil formation,participate in biogeochemical cycles and play an important role in the subsequent biological settlement and growth process.Over the past 100years,the global average temperature has increased by 0.74 ℃.One consequence of this temperature increase is that glaciers have retreated in many mountainous areas all over the world.The studies of the primary succession of microflora in the glacier foreland have become the research focus in recent years.In this paper,the microbial community and quantity variation in the glacier foreland,the role of microbial in the soil formation are reviewed.The change and function of N cycle relating microbial in the glacier foreland primary succession are also reviewed.The aim is to understand the rule and function of microbial succession in the glacier foreland and to provide some theoretical basis to ascertain microbial ecological functions in this special ecosystem.
Key words:glacier foreland;microbial ecology;study progress
中图分类号:Q938.1
文献标识码:A
doi:10.7522/j.issn.1000-0240.2013.0026
Wu Xiukun,Mao Wenliang,Tai Xisheng,et al.Progress in studies of microbial ecology in glacier foreland[J].Journal of Glaciology and Geocryology,2013,35(1):217-223.[伍修锟,毛文梁,台喜生,等.冰川前沿裸露地微生物生态学研究进展[J].冰川冻土,2013,35(1):217-223.]
收稿日期:2012-09-06;
修订日期:2012-11-26
基金项目:国家重点基础研究发展计划(973计划)项目(2012CB026105);国家自然科学基金项目(31170465;40971034);国家自然科学基础人才培养基金冰川学冻土学特殊学科点(J1210003/J0109)资助
* 通讯作者:刘光琇,E-mail:liugx@lzb.ac.cn
