新疆东帕米尔高原慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌多样性分析
【类型】期刊
【作者】李明源,王继莲,古丽巴哈尔·萨吾提(新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室;喀什大学叶尔羌绿洲生态与生物资源研究重点实验室)
【作者单位】新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室;喀什大学叶尔羌绿洲生态与生物资源研究重点实验室
【刊名】冰川冻土
【关键词】 洋布拉克冰川;PCR-RFLP;系统发育
【资助项】新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室开放课题(bryb1302);新疆维吾尔自治区高等学校科研计划项目(xjedu2014s052)资助
【ISSN号】1000-0240
【页码】P1634-1641
【年份】2019
【期号】第6期
【期刊卷】1;|7;|8;|2
【摘要】采用LB和PYGV两种培养基分离培养慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌,通过分离菌株16S r DNA的PCR-RFLP图谱和基于基因序列相似性的系统发育分析揭示细菌多样性.结果从样品中共分离到178株菌,分属于变形菌门(Proteobacteria)中的α-Proteobacteria、β-Proteobacteria、γ-Proteobacteria纲,厚壁菌门(Firmicutes),放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)6个类群,以假单胞菌Pseudomonas、黄杆菌Flavobacterium、紫色杆菌Janthinobacterium为优势菌群.LB和PYGV两种培养基在分离的细菌数量及种群多样性、优势菌属、特有菌属方面呈现一定差异.结果表明,慕士塔格峰洋布拉克冰川地区可培养细菌多样性丰富,且存在一定的地方特异性菌属,寡营养培养基更利于极端微生物的恢复生长.
【全文】 文献传递
新疆东帕米尔高原慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌多样性分析
摘 要:采用LB 和PYGV 两种培养基分离培养慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌,通过分离菌株16S rDNA 的PCR-RFLP 图谱和基于基因序列相似性的系统发育分析揭示细菌多样性.结果从样品中共分离到178 株菌,分属于变形菌门(Proteobacteria)中的α-Proteobacteria、β-Proteobacteria、γ-Proteobacteria 纲,厚壁菌门(Firmicutes),放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes)6 个类群,以假单胞菌Pseudomonas、黄杆菌Flavobacterium、紫色杆菌Janthinobacterium 为优势菌群.LB 和PYGV 两种培养基在分离的细菌数量及种群多样性、优势菌属、特有菌属方面呈现一定差异.结果表明,慕士塔格峰洋布拉克冰川地区可培养细菌多样性丰富,且存在一定的地方特异性菌属,寡营养培养基更利于极端微生物的恢复生长.
关键词:洋布拉克冰川;PCR-RFLP;系统发育
0 引言
冰川在地球上分布非常广泛,其低温、寡营养、强辐射的特点造就了独特的生态环境和生物特有现象,是天然的古环境信息库,对冰川微生物群落结构的研究已成为近年来冰川学研究热点之一[1,2].目前已从世界各地冰川生境中分离到大量细菌、病毒、雪藻、真菌等微生物资源[3-5],它们都能耐受低温环境,多来自于海洋、陆地、人类活动所形成的气溶胶及沉降于冰川表面的粉尘微粒,在冰川生态系统中具有不可替代的生态作用[6-8].我国科学家在冰川地区也相继开展了大量研究,取得了令人瞩目的成果,特别是对作为“世界第三极”的青藏高原上冰川细菌的研究,内容涉及不同冰川地区细菌群落结构及分布差异[9-10]、时空变化特征[11-12]、与气候环境的关系等[13].作为冰川环境的主要生命形式,对冰川细菌的研究不仅可进一步发掘新的低温微生物物种和基因资源,也为揭示生命的起源与进化、气候环境变迁及其对环境变化的适应策略等开辟新途径[14-15].
慕士塔格峰洋布拉克冰川地处我国西疆极地东帕米尔高原上,是慕士塔格峰西坡长度最长、冰川下延最低的一条山谷冰川[16],平均海拔4 000 m 以上,常年低温,气候干冽,为暖温带大陆性气候.目前对慕士塔格区冰川的研究多集中于冰川物质平衡、水文、气候等多方面,对微生物资源方面的研究较少[17-18].本文采用经典的纯培养分离技术培养慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌,通过建立分离菌株16S rDNA 基因的PCRRFLP 指纹图谱与序列同源性系统发育树,揭示该区域冰川雪冰及融水中可培养细菌多样性,为阐明不同细菌种群在冰川生态系统中的作用及低温功能菌株开发奠定基础,同时对微生物耐冷生理和遗传机制研究也有重要意义.
1 材料与方法
1.1 样品采集
2014 年5 月初,用灭菌铲采集慕士塔格峰洋布拉克冰川冰舌地区的冰、雪冰、污化冰及冰川融水样(75°08'E,38°25'N),从海拔4 578 m 的冰舌段开始沿冰川下伸依次取样直至冰川融水汇聚河(海拔分别为4 578、4 480、4 400、4 340、4 280、4 220、4 160、4 100、4 050、4 000、3 950、3 880 m),每个采样点取5 份.样品就地保存于无菌器皿中,低温条件下运至实验室,样品温度为-8 ~1 ℃,pH 值为7.2 ~8.0.
1.2 培养基
采用LB 和PYGV 培养基(参照DSMZ Medium621.PYGV AGAR,略有改动)对样品中细菌进行分离与培养.LB 培养基是完全培养基,营养成分丰富,而PYGV 培养基则是由多种无机盐离子组成的寡营养培养基,营养物质浓度较低.
1.3 主要试剂与设备
细菌基因组提取、胶回收试剂盒,限制性核酸内切酶、DNA Markers 及用于PCR 扩增的全套试剂购自TaKaRa 公司(大连).PCR 仪(Eppendorf Mastercycler pro S),电泳仪(北京六一),高速冷冻离心机(Eppendorf 5430R),凝胶成像系统(北京君意JY04-3E).
1.4 低温细菌的分离纯化及生长温度范围测定
细菌的分离采用稀释涂布平板法,15 ℃恒温倒置培养,待平板上菌落清晰可见时进行计数,依据形态、颜色、大小等不同表型特征,通过连续划线法获得纯菌株.依据采样地点与分离培养基不同,对分离菌株统一编号,如LH3、PB20 等.数字前两个大写字母分别表示培养基(LB 或PYGV)和采样点编号(A 至L),数字表示相同样品在相同培养基上的分离菌株序号.
菌株生长温度范围测定:采用点种法将分离菌株接种至LB 和PYGV 培养基上,分别置于4、10、15、20、25、30、37、42、45、50 ℃条件下恒温培养,观察统计菌落生长情况.每个温度做两个平行,同时设置空白对照.
1.5 分离菌株基因组DNA 提取及16S rDNA 扩增
采用TaKaRa 细菌基因组提取试剂盒提取分离菌株的基因组DNA,采用一对通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3'),1492R (5'-GGTTACCTTGTTACGACTT-3')[11]扩增16S rDNA.PCR 反应体系(50 μL):10×Taq buffer 5 μL,2.5 mmol·L-1 dNTP 2 μL,模板DNA 1 μL(约100 ng·μL-1),Taq 酶2.5 U,引物各0.5 μmol·L-1,ddH2 O 补齐至50 μL.PCR 扩增条件为:94 ℃预变性4 min,94 ℃变性45 S,58 ℃退火30 s,72 ℃延伸90 s,30 个循环,再72 ℃延伸10 min.PCR 产物通过琼脂糖凝胶电泳检测,目的DNA 片段经胶回收纯化后于-20 ℃保存.
1.6 分离菌株16S rDNA 的PCR-RFLP 分析
采用Msp Ⅰ和Hae Ⅲ对分离菌株16S rDNA的PCR 产物进行酶切,酶切反应体系(10 μL):10×酶切缓冲液1 μL,PCR 产物4 μL,内切酶0.5 μL,ddH2O 补齐至10 μL.37 ℃消化30 min 后取5 μL 通过2%的琼脂糖凝胶电泳检测,利用凝胶成像系统拍照并统计不同酶切片段大小,相同位置上有条带标记为1,无条带为0,应用Data Processing System(DPS)数据处理系统的遗传聚类模块对分离菌株的酶切图谱进行0、1 二元数据的遗传距离计算,将遗传距离矩阵转化格式后导入MEGA 6.0 软件,采用UPGMA 方法计算构建树状图[19],每一个特有的带谱类型作为一个分类操作单元(OTU,Operational Taxonomic Unit).
1.7 代表菌株16S rDNA 测序及系统发育分析
根据1.6 的聚类分析结果,从每个OTU 中选取1 株代表性菌株进行16S rDNA 测序及系统发育分析.将1.5 中PCR 回收产物连接到pMD 18-T vector 上,连接产物转化至E.coli DH5α,通过氨苄青霉素(100 μg/mL)平板挑选转化子,以M13 通用引物(Rv:5'-ATTTCACACAGGAAACAGCTATGAC-3', M4: 5'-GTTTTCCCAGTCACGACGTTCTAAA-3')进行菌落PCR 鉴定.阳性重组子送由生工生物工程(上海)股份有限公司完成测序.将获得的16S rDNA 序列提交到GenBank 数据库,登录号KT424942-KT424988.登陆NCBI 并通过BLAST在线比对分析序列同源性,获得相似度最高的同源菌株序列,利用ClustalX(Version1.83)软件进行多序列比对,通过MEGA6.0 软件用邻接法(Neighbor-Joining)构建系统进化树.
2 结果与分析
2.1 低温细菌的分离
依据不同菌落表型特征,从采集样品中共分离到178 株细菌,其中LB 培养基分离获得67 株,而PYGV 培养基则分离到111 株,几乎是LB 的2 倍,表明该冰川生境中的多数微生物不适合在富营养培养基上生长,寡营养条件反而提高了可培养细菌多样性.
所有菌株可在4 ~28 ℃生长,87 株能在4 ~37 ℃生长,仅有3 株的最高生长温度达45 ℃,属于嗜温菌(Mesophiles),表明从慕士塔格峰洋布拉克冰川地区分离的绝大多数菌株属于耐冷菌(Psychrotorlenrants),这与其他高山冰川的报道相符[17,20].揭示了冰川极端环境对微生物菌群的选择作用.
2.2 分离菌株16S rDNA 的PCR-RFLP 分析
分离菌株16S rDNA 的PCR 产物经1%的琼脂糖凝胶电泳检测,均得到约1 500 bp 的单一条带,分别用Msp Ⅰ和Hae Ⅲ对其酶切,酶切产物经2%的琼脂糖凝胶电泳检测显示了丰富的谱带类型(图1).根据酶切图谱差异聚类,LB 培养基分离的67株细菌被聚类分成20 个OTU,其中OTU12 有9 个菌株,其次是OTU1 和OTU3,各含8 个菌株,这3个OTU 共含25 株细菌,占总菌数的37%,是优势菌 群;OTU2、OTU6、OTU7、OTU8、OTU13、OTU14、OTU15、OTU16、OTU17、OTU18 单独成群;其余菌株被分成10 个OTU.PYGV 培养基分离的111 株细菌被归成27 个OTUs,其中OTU1 分支最大,包含27 株细菌,占总菌数的24%,是优势菌群;OTU19 和OTU4,各含10、9 株菌株,为次优 势 菌 群.OTU5、OTU7、OTU10、OTU16、OTU17、OTU18、OTU25、OTU26 单独成群,为稀有菌群.
2.3 代表菌株16S rDNA 序列分析与系统进化树构建
根据聚类分析结果,从每个OTU 中选取1 株代表性菌株进行16S rDNA测序及系统发育分析.LB 培养基的20 个OTU 的代表菌株16S rDNA 基因序列同源性系统发育分析表明(图2),在系统发育树上归类为6 个细菌发育类群:变形菌门(Proteobacteria)中的α-Proteobacteria、β-Proteobacteria、γ-Proteobacteria,厚壁菌门(Firmicutes),放线菌门(Actinobacteria)和拟杆菌门(Bacteroidetes);隶属于假单胞菌属(Pseudomonas)、不动杆菌属(Acinetobacter)、希瓦氏菌属(Shewanella)、气单胞菌属(Aeromonas)、紫色杆菌属(Janthinobacterium)、短波单胞菌属(Brevundimonas)、束毛球菌属(Trichococcus)、动性球菌属(Planococcus)、芽孢杆菌属(Bacillus)、节杆菌属(Arthrobacter)、黄杆菌属(Flavobacterium)11 个属.其中γ-Proteobacteria分支最大,含有4 个属10 个OTU 的代表菌株,其中OTU1、OTU3、OTU4、OTU10 与OTU14 与Pseudomonas 具有较高相似性,共27 株,占总菌数的40.3%,是LB 培养基分离的主要优势菌属;OTU2、OTU9、OTU12 共包括14 株细菌,与Shewanella相似性最高,占20.9%,是次优势菌群;OTU19 含有的4 株细菌与Aeromonas 相似性最高;OTU16 单独成群,与Acinetobacter 相似性最高.其余 各 门 中,α-Proteobacteria 占 7.46%,β-Proteobacteria 占1.49%,Firmicutes 占5.96%,Actinobacteria占11.94%,Bacteroidetes 占4.48%.
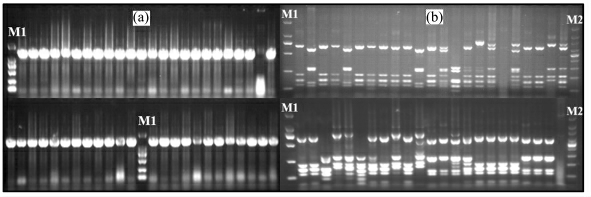
图1 部分菌株16S rDNA 扩增产物及PCR-RFLP 图谱
Fig.1 Partial results of 16S rDNA PCR amplification product and PCR-RFLP Atlas
A:Partial gel electrophoresis results of 16S rDNA PCR amplification product;B:Partial results of PCR amplification product digested by Msp Ⅰand Hae Ⅲ;M1:100 bp Ladder DNA Marker;M2:DL2000 DNA Marker
PYGV 培养基27 个OTU 的代表菌株16S rDNA序列在系统发育树上形成了γ-Proteobacteria、β-Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes 五个门类(图3),归属于Pseudomonas、Shewanella、Aeromonas、Janthinobacterium、Trichococcus、Arthrobacter、Flavobacterium、嗜冷菌属(Cryobacterium)、杜檊氏菌属(Duganella)、微小杆菌属(Exiguobacterium)10 个属.与LB 培养基相似,发育树中最大的分支也是γ-Proteobacteria,包含了10 个OTU 的54 株细菌,占总菌数的48.6%,尤以Pseudomonas 比例较大为35.1%,是PYGV 培养基分离的主要优势菌属.说明Pseudomonas 是该冰川地区的优势菌属,营养需求不高,因而在两种培养基中均能被培养成优势菌群.Bacteroidetes 分支中只有Flavobacterium 一个菌属,包含6 个OTU的26 株细菌,占23.4%,是第二优势菌属;OTU4、OTU6、OTU15、OTU22、OTU23 的代表菌株与Janthinobacterium 有较大相似性,占总菌数的21.6%,是第三优势菌属;OTU19 的代表菌株与Shewanella 具 有 较 高 相 似 性,OTU8、OTU24、OTU25 的代表性菌株都和Aeromonas 相似性最高;β-Proteobacteria 中有2 个属,包含6 个OTU,其中OTU5(Strain PH3 单独成群)与Duganella 相似性最高;Firmicutes 和Actinobacteria 各有2 个属,菌株数量所占比例最小,几乎都是单独聚类成群的稀有菌属.
综合两种培养基分离细菌多样性结果,慕士塔格峰洋布拉克冰川雪冰及融水中的可培养细菌归属于α-Proteobacteria、β-Proteobacteria、γ-Proteobacteria、Firmicutes、Actinobacteria、Bacteroidetes 6个类群中,隶属于Pseudomonas、Acinetobacter、Shewanella、Aeromonas、Janthinobacterium、Brevundimonas、Trichococcus、Planococcus、Bacillus、Arthrobacter、Flavobacterium、Cryobacterium、Duganella、Exiguobacterium 14 个属.以Pseudomonas、Flavobacterium、Janthinobacterium 为优势菌群,这与其它高山冰川、冻土地区的报道具有一定相似性[21-23].
3 讨论
对不同生态系统中可培养微生物菌株的分离是微生物生态学研究的基础,本研究基于细菌16S rDNA 基因的PCR-RFLP 图谱及序列系统发育分析,虽然揭示了该区域存在丰富的冰川细菌菌群结构,但也存在一定局限性.用RFLP 鉴别16S rDNA片段受到内切酶种类和数目的制约.使用单一内切酶,得到的OTU 数量有限,不能全面反映环境微生物群落组成;内切酶数量太多,又会给统计工作带来困扰且可能包含重复序列.本文采用MspⅠ和Hae Ⅲ两种酶对不同培养基分离菌株进行16S rDNA 的PCR-RFLP 多态性分析,得到的OTU 数量均不同,若选取其它酶,得到的OTU 数应该也不同.
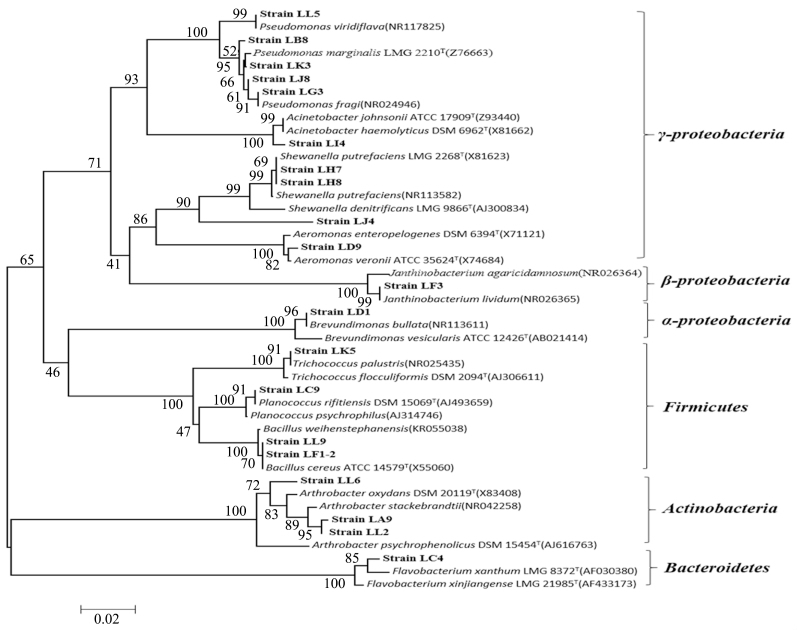
图2 LB 培养基20 个OTU 的代表性菌株系统发育树
Fig.2 Phylogenetic tree of twenty representative strains from each OTU isolated from LB medium
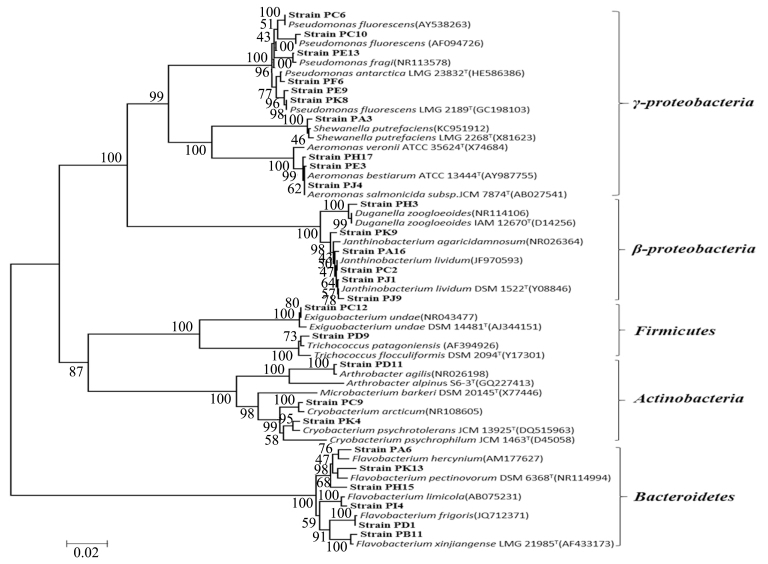
图3 PYGV 培养基27 个OTU 的代表性菌株系统发育树
Fig.3 Phylogenetic tree of twenty-seven representative strains from each OTU isolated from PYGV medium
不同冰川的形成过程、气候类型、海拔高度有显著差异,所蕴藏的低温细菌类群也不尽相同[24-28].本研究利用两种不同培养基获得的洋布拉克冰川细菌属于6 个系统发育类群,14 个属,与念青唐古拉山扎当冰川[29]、天山1 号冰川[15,30]、慕士塔格冰芯[31]的冰川菌类群有一定区别.其中Pseudomonas、Flavobacterium 在念青唐古拉山扎当冰川、天山1 号冰川、慕士塔格冰芯中均有分布,且都属于主要优势菌,表明不同地理格局的冰川优势菌属具有一定相似性.这可能与菌群性质有关,有研究表明此两类微生物在进化中形成了特殊的生理和结构适应机制以应对不同的低温生境,具备较强的生存竞争力[30,32].研究中还分离到一些独特类群,如Shewanella、Aeromonas、Duganella 等,尤其Shewanella 占LB 培养基分离总菌数的20.9%,为次优势菌群,但该属细菌在其它冰川中却鲜见报道,推测是地方特有类群.这是否与其所处冰川的地理格局及气候因素有关,又是否具有特殊的生理机制,尚需进一步探讨.
虽然LB 和PYGV 两种培养基分离细菌的系统发育类群基本相同,但在分离数量、优势菌属及特有菌属上仍表现出一定差异(表1).从计数结果看,PYGV 分离到的不同表型菌株数量几乎是LB的2 倍,OUT 类型也较LB 丰富,有利于各种形态或类群细菌的分离和检出.推测其原因一方面可能是绝大多数冰川微生物长期处于贫瘠营养状态,低营养浓度的培养基更利于它们的恢复培养,另一方面可能因LB 培养基为完全培养基,更利于微生物获取充足养分快速生长,但随之会产生一些能破坏细胞内膜结构、加速底物死亡的代谢产物,影响了微生物的可培养性[33].在优势菌属方面,二者除以Pseudomonas 为绝对优势菌外,在LB 培养基上还有次优势菌Shewanella,PYGV 培养基上则有第二,三优势菌Flavobacterium、Janthinobacterium.说明不同分离培养基分离优势菌群的能力不同,只有极少数营养需求简单的优势菌属能够在不同培养基上生长,单纯依靠纯培养技术阐明冰川中的优势微生物种群远远不够.
此外,两种培养基还各自分离到一些专有菌属,进一步证实了培养基对微生物的选择作用.因此,在分离培养极端微生物方面,培养基的选择显得尤为重要.大部分可培养细菌需要适宜的培养基类型,而单一培养基营养成分不足,制约了某些特定细菌种群的生长,分离到的细菌种类有限.就分离纯化冰川雪、冻土等适冷环境中的微生物而言,寡营养培养基更利于微生物的恢复生长,因此,联合使用多种寡营养培养基方能更全面获得冰川细菌多样性资料.
表1 不同培养基对冰川细菌多样性的影响
Table 1 The influence of different culture mediums on the glacier bacterial diversity

培养基 细菌数量 优势菌属 专有菌属LB 67 株 Pseudomonas、Shewanella Acinetobacter、Brevundimonas、Planococcus、Bacillus PYGV 111 株 Pseudomonas、Flavobacterium、Janthinobacterium Cryobacterium、Duganella、Exiguobacterium
实验虽采用不同培养基分离低温细菌,解析微生物菌群结构,但限于各方面因素(营养源、生长温度、需/厌氧等)得到的可培养细菌数量有限.因此,在后期工作中应继续探寻新型培养技术,优化培养条件,模拟冰川区原位环境以获得更多的可培养微生物类群.再者,鉴于自然界绝大部分微生物目前仍不易通过纯培养获得,还应结合非培养技术的优越性进行原位检测和揭示微生物多样性.通过两种方法的相互补充比较,更全面、客观地评估冰川微生物多态性,为我国低温细菌资源的开发利用、抗逆基因的挖掘、耐冷机制研究等提供材料支撑,为探究微生物与环境的互作关系及影响机理奠定基础.
参考文献(References):
[1] Anesio A M,Johanna L P.Glaciers and ice sheets as a biome[J].Trends in Ecology&Evolution,2012,27(4):219-225.
[2] Laurent P,Dagmar T,David B,et al.Distribution of high bacterial taxa across the chronosequence of two alpine glacier forelands[J].Microbial Ecology,2011,61(2):303-312.
[3] Gu Yanling,Shi Xuewei,Zhu Jianbo,et al.Vertical distribution pattern of the archaeaea community within the permafrost active layer in front of the glacier No.1 at headwaters of Ürümqi River,Tianshan Mountains[J].Journal of Glaciology and Geoaryology,2013,35(3):761-769.[顾燕玲,史学伟,祝建波,等.天山乌鲁木齐河源1 号冰川前沿冻土活动层古菌群落的垂直分布格局[J].冰川冻土,2013,35(3):761-769.]
[4] López-Bueno A,Tamames J,Velázquez D,et al.High diversity of the viral community from an Antarctic lake[J].Science,2009,326(5954):858-861.
[5] Amato P,Hennebelle R,Magand O,et al.Bacterial characterization of the snow cover at Spitzberg,Svalbard[J].FEMS Microbiology Ecology,2007,59(2):255-264.
[6] Sattler B,Puxbaum H,Psenner R.Bacterial growth in supercooled cloud droplets[J].Geophysical Research Letters,2001,28(2):239-242.
[7] Segawa T,Miyamoto K,Ushida K,et al.Seasonal change in bacterial flora and biomass in mountain snow from the Tateyama Mountains,Japan,analyzed by 16S rRNA gene sequencing and real-time PCR[J].Applied and Environmental Microbiology,2005,71(1):123-130.
[8] Ma L,Rogers S O,Catranis C M,et al.Detection and characterization of ancient fungi entrapped in glacial ice[J].Mycologia,2000,92(2):286-295.
[9] Ma Xiaojun,Liu Wei,Hou Shugui,et al.Culturable bacteria in snow pits of different type glaciers:diversity and relationship with environment[J].Journal of Glaciology and Geoaryology,2009,31(3):483-489.[马晓军,刘炜,侯书贵,等.不同类型冰川雪中可培养细菌多样性变化及其与环境因子关系研究[J].冰川冻土,2009,31(3):483-489.]
[10]Xie Jun,Wang Ninglian,Pu Jianchen,et al.Study of the bacterial diversity recovered from glacial snow of the northern Tibetan Plateau[J].Journal of Glaciology and Geoaryology,2009,31(2):342-349.[谢君,王宁练,蒲健辰,等.青藏高原北部冰川雪中细菌多样性的研究[J].冰川冻土,2009,31(2):342-349.]
[11]Liu Yongqin,Yao Tandong,Kang Shichang,et al.Seasonal variation of snow microbial community structure in the East Rongbuk glacier,Mt.Everest[J].Chinese Science Bulletin,2006,51(11):1287-1296.[刘勇勤,姚檀栋,康世昌,等.珠穆朗玛峰地区东绒布冰川冰雪微生物群落及其季节变化[J].科学通报,2006,51(11):1287-1296.]
[12]Liu Xiaobo,Kang Shichang,Yao Tandong,et al.The seasonal change of bacterial abundance and diversity in snow of the Guoqu glacier,Mt.Geladandong[J].Journal of Glaciology and Geoaryology,2009,31(4):634-641.[刘晓波,康世昌,姚檀栋,等.各拉丹冬峰果曲冰川雪中细菌的季节变化特征[J].冰川冻土,2009,31(4):634-641.]
[13]Zhang Gaosen,Zhang Wei,Liu Guangxui,et al.Distribution of aerobic heterotrophic bacteria managed by environmental factors in foreland[J].Journal of Glaciology and Geoaryology,2012,34(4):965-971.[章高森,张威,刘光琇,等.环境因素主导着冰川前沿裸露地好氧异养细菌群落的分布[J].冰川冻土,2012,34(4):965-971.]
[14]Zhang Shuhong,Hou Shugui,Qin Xiang,et al.Preliminary research on the dominant bacterial population affected by retreat of the Laohugou glacier No.12 in the Qilian Mountain[J].Journal of Glaciology and Geoaryology,2013,35(3):751-760.[张淑红,侯书贵,秦翔,等.祁连山老虎沟12 号冰川退缩对细菌优势种群影响的初步研究[J].冰川冻土,2013,35(3):751-760.]
[15]Wu Xiukun,Mao Wenliang,Tai Xisheng,et al.Progress in studies of microbiology ecology in glacier foreland[J].Journal of Glaciology and Geoaryology,2013,35(1):217-223.[伍修锟,毛文梁,台喜生,等.冰川前沿裸露地微生物生态学研究进展[J].冰川冻土,2013,35(1):217-223.]
[16]Pu Jianchen,Yao Tandong,Duan Keqin,et al.An observation on surface ablation on the Yangbark glacier in the Muztag Ata,China[J].Journal of Glaciology and Geoaryology,2003,25(6):680-684.[蒲健辰,姚檀栋,段克勤.慕士塔格峰洋布拉克冰川消融的观测分析[J].冰川冻土,2003,25(6):680-684.]
[17]Xiang Shurong,Yao Tandong,Wu Guangjian,et al.Vertical quantitative and dominant population distribution of the bacteria isolated from the Muztagata ice core[J].Science in China(Series D:Earth Sciences),2005,35(3):252-262.[向述荣,姚檀栋,邬光剑,等.慕士塔格冰芯可培养细菌的数量分布和主要菌群结构随深度的变化[J].中国科学(D 辑:地球科学),2005,35(3):252-262.]
[18]Shang Tiancui,Xu Bingliang,Xiang Shurong,et al.Physiological characteristics of isolates from the Muztag Ataice core and sequence analysis of Staphylococcus equorum Muzt-D84 cspA gene[J].Journal of Gansu Agricultural University,2007,42(4):65-70.[尚天翠,徐秉良,向述荣,等.慕士塔格冰芯细菌的生理特征以及葡萄球菌Muzt-D84 cspA 基因序列分析[J].甘肃农业大学学报,2007,42(4):65-70.]
[19]Li Yaling,Han Guomin,He Sha’e,et al.A new strategy for construction of Phylogenetic tree based on DNA molecular mark data[J].China Journal of Bioinformatics,2008,6(4):168-170.[李亚玲,韩国民,何沙娥,等.基于DNA 分子标记数据构建系统进化树的新策略[J].生物信息学,2008,6(4):168-170.]
[20]Christner B C,Thompson E,Thompson L G,et al.Recovery and identification of viable bacteria immured in glacier ice[J].Icarus,2000,144(2):479-485.
[21]Yao T D,Xiang S R,Zhang X J,et al.Microorganisms in the Malan ice core and their relation to climatic and environmental changes[J].Global Biogeochemical Cycles,2006,20(1):doi:10.1029/2004GB002424.
[22]Wei Yunlin,Zhou Changtao,Ji Xiuling,et al.Phylogenetic analysis of several pseudomonas strains isolated from Mingyong glacier[J].Journal of Yunnan university(Natural Science),2007,27(S1):408-412.[魏云林,周长涛,季秀玲,等.明永冰川地区假单胞菌的分离及系统发育分析[J].云南大学学报(自然科学版),2007,27(S1):408-412.]
[23]Li Miao,Feng Haiyan,Yang Zhongfang,et al.Diversity of culturable bacteria in the typical frozen soil areas in China[J].Acta Microbiologica Sinica,2011,51(12):1595-1604.[李淼,冯海艳,杨忠芳,等.中国典型冻土区土壤可培养细菌多样性[J].微生物学报,2011,51(12):1595-1604.]
[24]Doyle S,Montross S N,Skidmore M,et al.Characterizing microbial diversity and the potential for metabolic function at -15℃in the basal ice of Taylor Glacier,Antarctica[J].Biology,2013,2(3):1034-1053.
[25]Ganzert L,Bajerski F,Wagner D.Bacterial community composition and diversity of five different permafrost-affected soils of Northeast Greenland[J].FEMS Microbiology Ecology,2014,89(2):426-441.
[26]Lay C Y,Mykytczuk N C S,Niederberger T D,et al.Microbial diversity and activity in hypersaline high Arctic spring channels[J].Extremophiles,2012,16(2):177-191.
[27]Liu Y Q,Yao T D,Jiao N Z,et al.Culture bacteria in glacial meltwater at 6 350 m on the East Rongbuk Glacier,Mount Everest[J].Extremophiles,2008,13(1):89-99.
[28]Steven B,Pollard W H,Greer C W,et al.Microbial diversity and activity through a permafrost/ground ice core profile from the Canadian high Arctic[J].Environmental Microbiology,2008,10(12):3388-3403.
[29]Yue Jun,Liu Guangxiu,Zhang Gaose,et al.Changes in soil properties and culturable bacteria diversityin Zhadang glacier foreland[J].Journal of Glaciology and Geoaryology,2010,32(6):1180-1185.[岳君,刘光琇,章高森,等.念青唐古拉山扎当冰川退缩前沿土壤性质与可培养细菌多样性变化[J].冰川冻土,2010,32(6):1180-1185.]
[30]Tao Ling,Gu Yanling,Zheng Xiaoji,et al.Cultivable bacteria isllated from the meltwater of the glacier No.1 at headwater of the Ürümqi River in Tianshan Mountains physiological-biochemical character and phylogeny[J].Journal of Glaciology and Geoaryology,2015,37(2):511-521.[陶玲,顾燕玲,郑晓吉,等.天山乌鲁木齐河源1 号冰川融水可培养细菌生理生化特性及其系统发育[J].冰川冻土,2015,37(2):511-521.]
[31]Xiang S,Yao T D,An L Z,et al.Vertical quantitative and dominant population distribution of the bacteria isolated from the Muztagata ice core[J].Science in China(Series D:Earth Science),2005,48(10):1728-1739.
[32]Zhu F,Wang S,Zhou P.Flavobacterium xinjiangense sp.nov.and Flavobacterium omnivorum sp.nov.,novel psychrophiles from the China No.1 Glacier[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(3):853-857.
[33]Simu K,Hagström Å.Oligotrophic bacterioplankton with a novel single-cell life strategy[J].Applied and Environmental Microbiology,2004,70(4):2445-2451.
Culturable bacterial diversity in snow,ice and meltwater of the Yangbark Glacier,Muztag Ata
Abstract:LB and PYGV culture medium were used to isolate the culturable bacterial in snow,ice and meltwater of the Yangbark Glacier,Muztag Ata,and the diversity of the isolates were analyzed based on the 16S rDNA PCR-RFLP and the phylogenetic analysis of 16S rRNA gene homology.The result indicated that a total of 178 bacterial strains were obtained,affiliated to six phyla as follows:α-Proteobacteria,β-Proteobacteria,γ-Proteobacteria,Firmicutes,Actinobacteria and Bacteroidetes,with Pseudomonas,Flavobacterium and Janthinobacterium strains being dominant.There were differences in bacterial number and diversity,dominant genera,specific genera between LB and PYGV culture medium.The results suggest that the glacier bacteria are abundant,some endemic genera exist in Yangbark Glacier,and the oligotrophic culture medium is more profitable for the growth of extreme microorganisms.
Key words:Yangbark Glacier;PCR-RFLP;phylogenetic analysis
中图分类号:P938.1
文献标志码:A
文章编号:1000-0240(2015)06-1634-08
doi:10.7522/j.isnn.1000-0240.2015.0180
Li Mingyuan,Wang Jilian,Gulbahar Sawut.Culturable bacterial diversity in snow,ice and meltwater of the Yangbark Glacier,Muztag Ata[J].Journal of Glaciology and Geocryology,2015,37(6):1634-1641.[李明源,王继莲,古丽巴哈尔·萨吾提.新疆东帕米尔高原慕士塔格峰洋布拉克冰川雪冰及融水中可培养细菌多样性分析[J].冰川冻土,2015,37(6):1634-1641.]
收稿日期:2015-08-20;
修订日期:2015-11-05
基金项目:新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室开放课题(BRYB1302);新疆维吾尔自治区高等学校科研计划项目(XJEDU2014S052)资助
