天山乌鲁木齐河源1号冰川融水可培养细菌生理生化特性及其系统发育
【类型】期刊
【作者】陶玲,顾燕玲,郑晓吉,关波,董娟,倪永清,程国栋(石河子大学食品学院;中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室)
【作者单位】石河子大学食品学院;中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室
【刊名】冰川冻土
【关键词】 天山;乌鲁木齐河源1号冰川;融水;系统发育;低温酶;耐药性
【资助项】国家自然科学基金项目(40961002;41140009;41271268);中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室开放基金项目(sklfse200903);中国博士后科学基金...
【ISSN号】1000-0240
【页码】P511-521
【年份】2019
【期号】第2期
【期刊卷】1;|7;|8;|2
【摘要】对天山乌鲁木齐河源1号冰川末端融水细菌进行分离,检测了分离菌株的生理生化表型特征,通过16S rRNA基因序列分析确定分离菌株的系统进化地位.结果表明:天山乌鲁木齐河源1号冰川融水中分离的36株代表菌株分属于5个系统发育类群、8个属,其中,Bacteroidetes和γ-Proteobacteria为优势类群,分别占41.7%和38.9%;在属水平上,假单胞菌属(Pseudomonas)菌株占39%.依据菌株最适生长温度,36株分离菌株80%以上属于耐冷菌;产酶实验显示,大多数菌株同时产蛋白酶和脂肪酶,仅3株菌不产酶,6株菌同时产脂肪酶、淀粉酶、蛋白酶.耐药性试验表明,36株分离菌株对各种抗生素有不同程度的耐药,其中,7株菌对测试的10种抗生素均具有耐药性.研究结果将有助于了解天山乌鲁木齐河源1号冰川微生物物种多样性、生理多样性,同时为评估气候变化、人类活动对冰川微生物生理特性潜在的影响提供依据.
【全文】 文献传递
天山乌鲁木齐河源1号冰川融水可培养细菌生理生化特性及其系统发育
摘 要:对天山乌鲁木齐河源1号冰川末端融水细菌进行分离,检测了分离菌株的生理生化表型特征,通过16S rRNA基因序列分析确定分离菌株的系统进化地位.结果表明:天山乌鲁木齐河源1号冰川融水中分离的36株代表菌株分属于5个系统发育类群、8个属,其中,Bacteroidetes和γ-Proteobacteria为优势类群,分别占41.7%和38.9%;在属水平上,假单胞菌属(Pseudomonas)菌株占39%.依据菌株最适生长温度,36株分离菌株80%以上属于耐冷菌;产酶实验显示,大多数菌株同时产蛋白酶和脂肪酶,仅3株菌不产酶,6株菌同时产脂肪酶、淀粉酶、蛋白酶.耐药性试验表明,36株分离菌株对各种抗生素有不同程度的耐药,其中,7株菌对测试的10种抗生素均具有耐药性.研究结果将有助于了解天山乌鲁木齐河源1号冰川微生物物种多样性、生理多样性,同时为评估气候变化、人类活动对冰川微生物生理特性潜在的影响提供依据.
关键词:天山;乌鲁木齐河源1号冰川;融水;系统发育;低温酶;耐药性
0 引言
地球上的冰川主要分布在南北两极及环极地地区,以及中低纬度的高海拔山地,约占地球陆地总面积的10%[1].越来越多的资料表明,冰川生境栖息着各种类群的微生物,包括细菌、蓝细菌、酵母菌、真菌和藻类以及嗜冷的古菌,这些微生物对冰冻圈环境的生物地球化学循环起着不同的作用[2-6].对南北极地区及其他一些山岳冰川的冰芯、积雪、融水、底部沉积物中的可培养微生物多样性分析显示,在门水平上,冰川生境分布最广泛的微生物类群包括 Proteobacteria、Bacteroidetes、Actinobacteria,由于冰川地理分布的不连续性以及不同冰川特殊的周边环境、地质水文、矿物学组成差异,冰川底部及其融水的微生物群落在种、属水平上明显不同[7-9].近年来,国内对青藏高原冰川微生物的关注渐多,冰川前沿裸露地微生物的地理分布[10-11]及对慕士塔格冰川冰芯[12]、青藏高原中部普若岗日冰芯[13]中的可培养细菌多样性进行了研究,通过嗜冷菌、耐冷菌菌群垂直分布及数量变化的研究,探索了冰川冰芯微生物对气候变化的指示作用[14].
天山乌鲁木齐河源1号冰川(简称天山1号冰川)(43°07.12'N,86°48.70'E)位于新疆乌鲁木齐市区西南120余公里处的天格尔山中,是天山中段北坡干旱地区的固体水库、绿洲摇篮及生产、生活的主要水资源之一.冰川海拔3800~4000 m,长约2.4 km,平均宽度500 m,面积1.95 km2,其周围分布着大小76条现代冰川[15].1958年以来收集的资料显示,天山1号冰川的消融速度加快,面积持续缩减.据研究推算,大气温度平均升高0.8℃,天山1号冰川平均面积缩小14%,厚度平均减薄11 m[16].目前为止,天山1号冰川是我国系统地长时间观测水文径流量、气象变化、物质平衡、退缩速度等数据最为完备的冰川[15].此外,天山1号冰川是世界上距离城市最近、交通最方便的冰川,因此冰川容易受到周边环境及人类活动的影响,其中的微生物很可能是这些影响的最敏感指示物.
目前,对于天山 1号冰川周边冻土[17-19]、积雪[20]、冰芯[21]细菌多样性和系统发育类群已有报道.本研究采用16S rRNA基因对天山1号冰川末端融水径流中可培养细菌的系统发育进行分析,详细研究了细菌菌株的最适生长温度、耐盐性、抗生素耐药性及产酶性能等生理生化特性,以期为冰川融水与周边环境微生物的多样性及空间分布格局差异的比较研究提供参考依据,尤其为评估周边地区人类活动、区域气候变化对冰川微生物的影响提供指导,同时,为认识和发掘天山1号冰川嗜冷微生物菌种的生物技术潜力提供参考.
1 材料和方法
1.1 样品采集及处理
2012年10月5日,在海拔3833 m的新疆天山乌鲁木齐河源1号冰川西支尾部采集冰川融水样品,将冰、水样品迅速装入己灭菌的样品桶中-4~2℃便携式车载冰箱4 h内运回实验室,先通过ø47mm·(1μm)-1的 whatman滤纸预过滤,再通过 ø47mm·(0.20μm)-1的滤纸过滤.部分过滤物连同滤纸转入无菌的50 mL心管,冻存在-80℃超低温冰柜,用于分菌的过滤物立即处理用于涂布平板分离.以上所有过程均在无菌条件下完成.
1.2 材料
1.2.1 主要试剂和仪器
用于PCR扩增的全套试剂及扩增引物均购自TaKaRa公司.相关生理生化试验所用试剂均购自于天津市巴斯夫化学试剂厂及天津市致远化学试剂厂.高速冷冻离心机为Thermo公司Fresco21型;PCR仪为德国Biometra公司的Tprofessional;凝胶成像系统为BioRad公司Gel DOC XR;水平电泳仪为美国BioRad公司的PowerPac Universal、电泳槽SUBCELL GT(20cm×25cm).
1.2.2 培养基
(1)平板分离培养基:1/10×TSB、1/4×TSB(BD公司)、1/10×R2A、1/4×R2A(Difco);(2)液体富集培养基:1/4×TSB;(3)斜面保存培养基:1/4×R2A培养基1.5%琼脂;以上培养基pH值均为7.2,121℃灭菌20min.
1.3 菌株的分离与纯化
用无菌过滤器(膜孔径为0.22μm)和滤膜真空泵过滤冰川尾部融水150 mL,将滤膜悬浮在冰冷的2 mL的0.9%生理盐水中,充分震荡以悬浮细菌细胞,梯度稀释后取200μL稀释液分别涂布在1/10×TSB、1/4×TSB、1/10×R2A、1/4×R2A的培养基表面,一式两份在4℃、20℃分别培养30~45 d、5~10 d.依据形成菌落的颜色、大小、形态差异以及细胞形态、革兰氏染色,将典型菌落在1/4×TSB平板连续划线三次分离纯化,纯培养物的新鲜培养液加入灭菌甘油(浓度保持在15%~20%)冷冻保藏在-70℃冰箱.用无菌水150 mL按上述同样方法处理,作为阴性对照.
1.4 分离菌株的生长特性的测定
菌株最适生长温度测定:分别置于4、10、15、18、21、24、30、37℃共8个温度梯度下,1/10×TSB液体培养,间隔2~4 h测OD600值.每个温度梯度做两个平行样,同时设置空白对照.菌株最适耐盐性测定:在1/10×TSB液体培养基中分别加入氯化钠至0%、2%、4%、6%、8%、10%共6个梯度浓度,16℃培养,间隔2~4 h测OD600值.每个浓度梯度做两个平行样,同时设置空白对照.
1.5 恢复出的细菌16S rRNA基因PCR扩增和系统发育分析
根据文献[22]报导的方法提取单菌落DNA,用细菌16S rRNA基因通用引物(正向引物27f:5'-GAGAGTTTGATCCTGGCTC AG-3',反向引物1492r:5'-CTACGGCTACCTTGTT ACGA-3')进行PCR扩增.PCR反应条件为:94℃预变性5min,(94℃ 1min,55℃ 1min,72℃ 1min,30个循环)72℃延伸7min.PCR产物纯化后,由上海生美吉物科技有限公司采用正向扩增引物直接测序.将测序结果提交到GenBank数据库中,序列同源性分析利用BLAST在线进行.从数据库获得相关属、种的16S rRNA基因序列,建立系统发育树.用CLUSTAL X 1.83 软件对序列进行比对[23],用邻接法neighbor-joining method计算进化距离,采用p-distances 法和 Kimura-2parameter 双参数法进行,进化树分支模式的稳定性用 MEGA 5.0[23]软件分析,采用Bootstrap法,重复次数为1000次.
1.6 细菌菌株生理生化鉴定
按照东秀珠等[24]描述的方法进行,利用5种常规的生化鉴定试验及6种常见碳源利用试验来检测分离菌株的表型特征的多样性,培养温度为16℃.
1.7 药敏试验
本实验依据美国临床实验室标准委员会(NCCLS)标准,利用琼脂纸片扩散法(K-B)检测分离菌株耐药性,包括氨基糖苷类:链霉素(streptomycin,STM)、新霉素(neomycin,NEO);青霉素(penicillin,PEN)、四环素(tetracycline,TET);氯霉素(chloramphenicol,CLM);大环内脂类:红霉素(erythromycin,ERM);奎诺醌类:萘啶酸(nalidixic acid,NC);头孢菌素类:头孢噻肟(cefotaxime,CTX);以及利福平(rifampicin,RIF)和杆菌肽(bacitracin,BAT)共10种临床常用抗生素药物进行试验,具体方法参见文献[25].所有药敏试验均在R2A琼脂培养基中进行,16℃培养5~7 d,测量其抑菌圈直径.
1.8 分离菌株产酶活性
本研究对所有分离菌株的产酶特性进行研究,主要是菌株对蛋白酶、脂肪酶、淀粉酶和纤维素酶四种酶的产酶情况.产酶菌株的筛选是在基础培养基中分别加入0.3%的脱脂乳、1%的Tween-80及0.01%的CaCl2、0.2%的可溶性淀粉和1%的羟甲基纤维素.所有菌株产酶检测均在16℃培养5~6 d,观察是否有水解圈并测量水解圈直径大小,以此判定酶活力的大小.
2 结果
2.1 低温菌株的筛选
分离后的菌株依据菌落颜色、形态、革兰氏染色、细胞形态及液体培养特征观察初步从冰川融水样品中共分离纯化得到265个分离物,依据菌落、细胞形态特征选择36株分离物为代表菌株(图1).36株分离菌株的菌落颜色主要为乳白色(11株)、黄色(16株)、红色(9株);大部分菌株菌落形态都很小,仅 TRB-4、TRB-6、TRB-12、TRB-14、TRB-20、TRB-22六株菌的菌落形态较大.革兰氏染色结果表明,36株低温菌株中有12株为革兰氏阴性菌,占总数的34%;24株为革兰氏阳性菌,占总数的66%;36株菌中有13株是球状,其余为杆状.菌株的菌落大小、颜色、形态及细胞形态统计见图1.
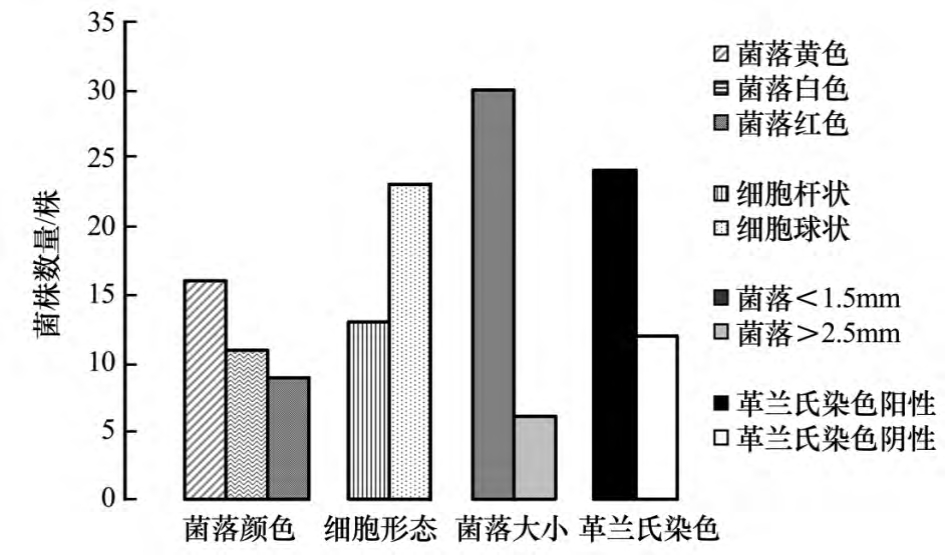
图1 天山1号冰川融水细菌形态特征统计
Fig.1 Morphological summary of the bacterial isolated from the meltwater of the Glacier No.1 in Tianshan Mountains
2.2 分离菌株的最适生长温度及耐盐性
分离所得36株细菌菌株中,11%最适生长温度为16℃左右,最高生长温度为30℃,多数菌株在30℃不生长,属于嗜冷菌;72%的最适生长温度为24℃左右,最高生长温度为37℃,属耐冷菌;TRB-8、TRB-12、TRB-23、TRB-26、TRB-38 五株菌的最适生长温度为37℃,不属于耐冷菌范畴.耐盐性实验结果表明,38株细菌菌株中大多部分菌株的最大耐盐度为6%,只有7株菌的最高耐盐度高达10%,而其他菌株在此浓度下都停止生长(表 1).
2.3 基于部分16S rRNA基因序列细菌菌株系统发育分析
从天山1号冰川融水样品中分离到36株细菌,将36株菌的16S rRNA 基因序列(0.2~1.2 kb)提交到NCBI,通过Blast工具在GenBank数据库中与已有的16S rRNA基因序列进行同源性比较,选取同源性在98%以上的序列构建系统发育树(图2).由系统发育树可知,天山1号冰川融水样品分离到的36株细菌分属于α-变形细菌亚纲(α-Proteobacteria)、β-变形细菌亚纲(β-Proteobacteria)、γ-变形细菌亚纲(γ-Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)5个门或亚纲水平的系统发育类群,其中,Bacteroidetes和 γ-Proteobacteria各占总类群成分的41.7%和38.9%,为优势类群.
图3和表1显示,天山1号冰川融水中的细菌隶属于Bacteroidetes的最多,共15株,根据16S rRNA基因序列相似性,分别归属于Flavobacterium属(12株)、Pedobacter(2株)、Cytophaga属(1株).依据16S rRNA基因序列相似性标准,Bacteroidetes是多样性最高的类群.其中,菌株TRB-12、TRB-22、TRB-23、TRB-27、TRB-20 与 Flavobacterium hercynium序列同源性均达到99%以上,菌株TRB-11与 Flavobacterium hydatis亲缘关系较近,菌株 TRB-24、TRB-29 与Pedobacter duraquae的16S rDNA序列相似性达到100%,可确定隶属于该种.
表1 天山1号冰川溶水细菌菌株的表型特征
Table1 Phenotypic characteristics of bacterial strains isolated from meltwater of the Glacier No.1 in Tianshan Mountains
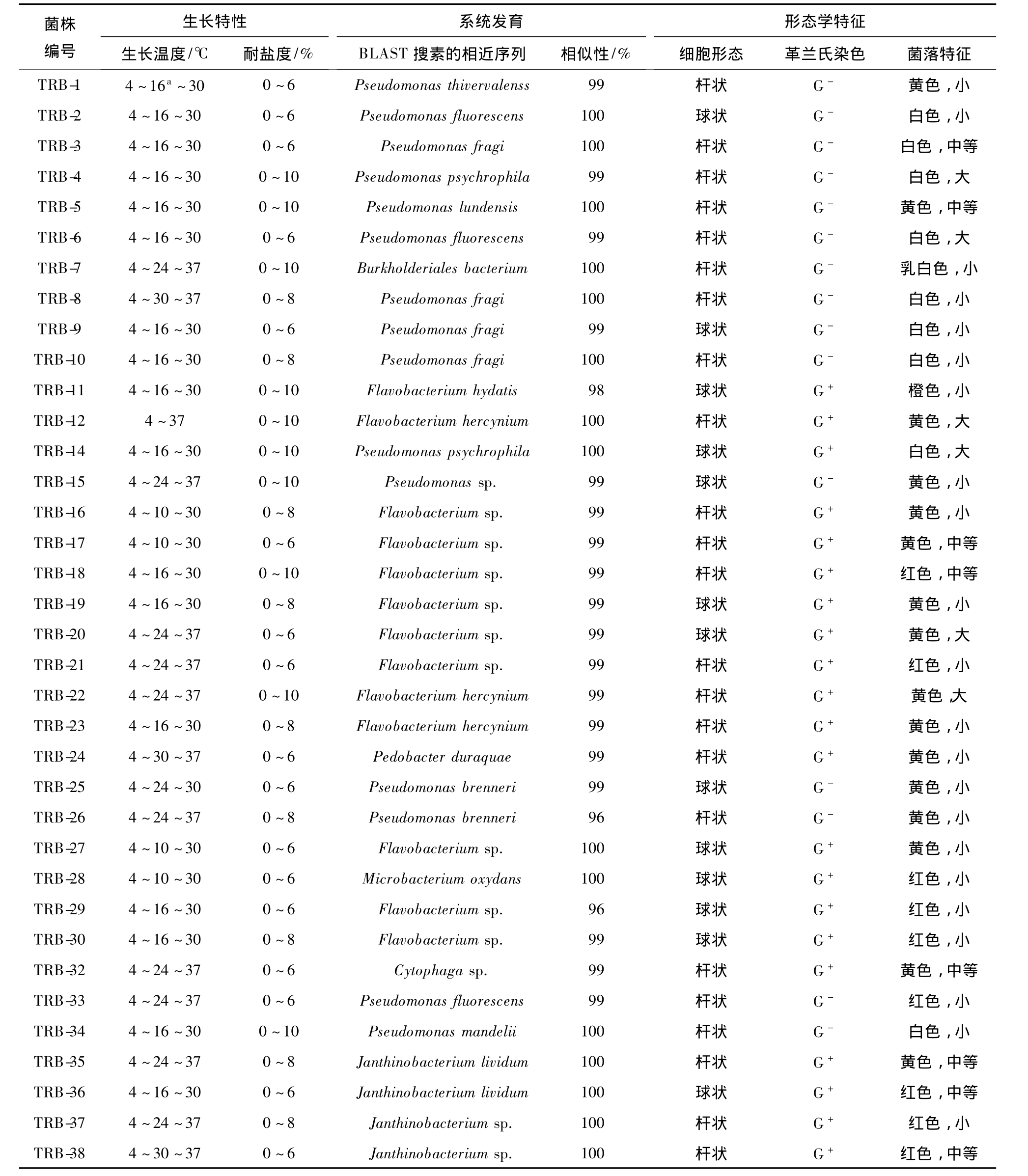
注:a最适生长温度
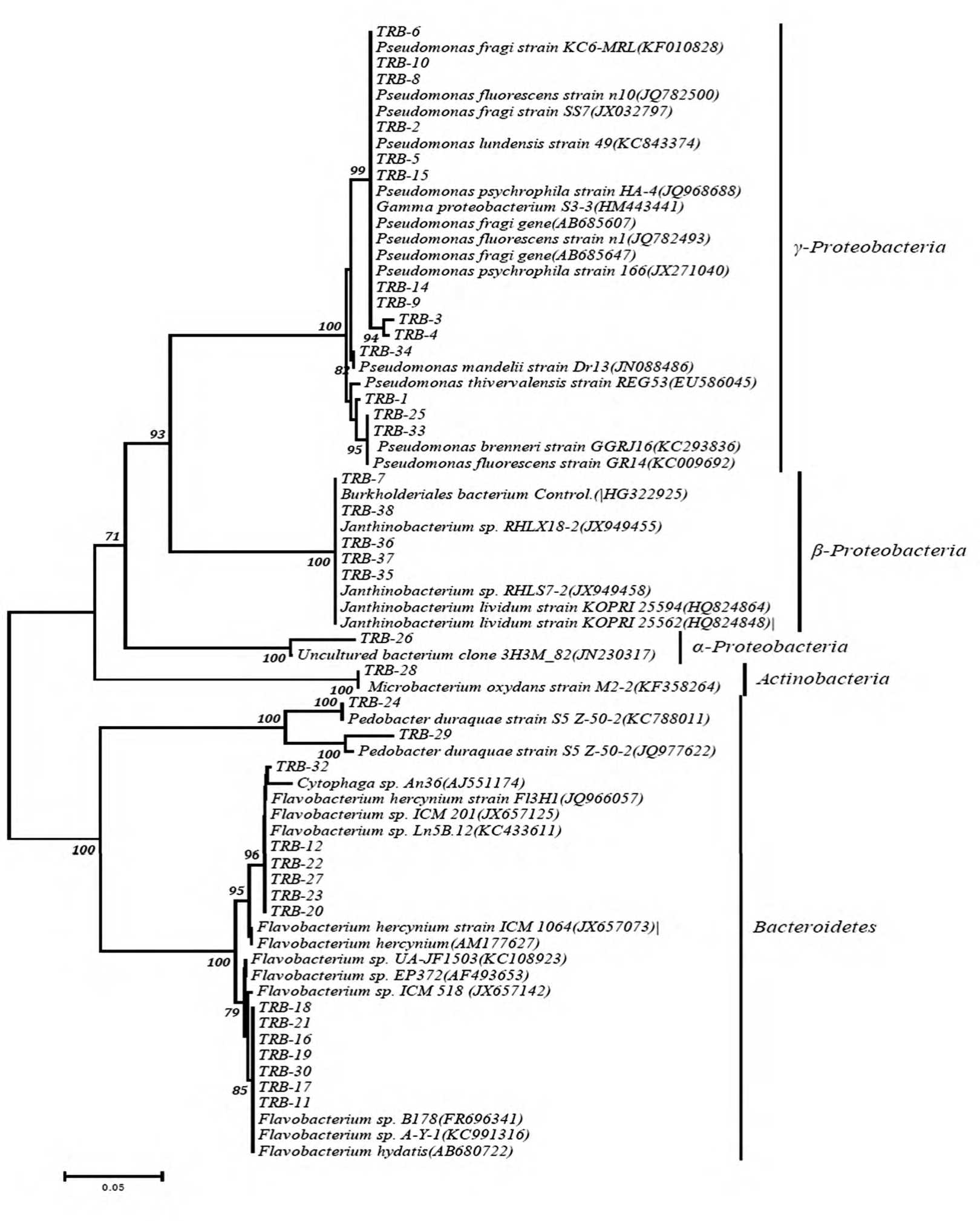
图2 基于部分16S rRNA基因序列天山1号冰川融水细菌菌株系统发育树
Fig.2 Neighbor-joining tree showing the phylogenetic relationships among 16S rRNA gene partial sequences of bacterial strains isolated from the meltwater of the Glacier No.1
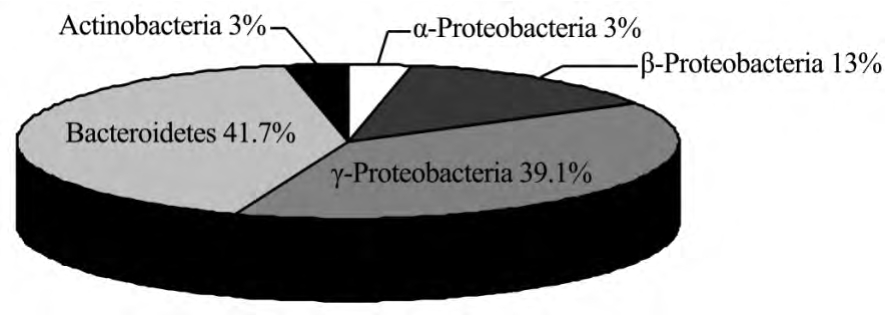
图3 天山1号冰川融水细菌16S rRNA基因主要系统发育类群的组成
Fig.3 Composition of the bacterial 16 s rRNA gene major phylogenetic groups from the meltwater of the Glacier No.1 in Tianshan Mountains
隶属于γ-变形细菌亚纲(14株)的较多,根据16S rRNA基因序列相似性比较,这14株菌全部归属于 Pseudomonas.其中,菌株 TRB-1与 Pseudomonas thivervalensis亲缘关系较近,TRB-5 与Pseudomonas lundensis亲缘关系最近,TRB-25与已知种Pseudomonas brenneri序列同源性较高,TRB-4、TRB-14 与 Pseudomonas psychrophila亲缘关系最近.菌 株 TRB-3、TRB-8、TRB-9、TRB-10 与Pseudomonas fragi、Pseudomonas fluorescens等多株典型菌株16S rRNA基因相似性在98%以上.此外,隶属于β-Proteobacteria亚纲的菌株包括TRB-7、TRB-38、TRB-36、TRB-37、TRB-35,均归属于Janthinobacterium,均与 Janthinobacterium lividum 16S rDNA序列相似性为100%.
2.4 菌株生理生化特征分析
依据《常见细菌系统鉴定手册》对分离细菌进行相应的生化试验(表2),其结果表明:大部分菌株的V-P、明胶液化、接触酶及硝酸盐还原试验呈阳性,而M.R试验仅13%显阳性.Pseudomonas属的V-P、硝酸盐还原及接触酶大多数呈阳性,M.R呈阴性,明胶液化呈阳性.菌株TRB-35、TRB-38、TRB-36、TRB-37 都是隶属于 Janthinobacterium 属,其明胶液化和接触酶均为阳性,M.R为阴性,而V-P和硝酸盐还原试验结果不同,TRB-35和TRB-38的V-P显阳性,硝酸盐还原显阴性,而TRB-36和TRB-37的 V-P显阴性,TRB-36的硝酸盐还原呈阳性,TRB-37的硝酸盐还原呈阴性.Flavobacterium属的菌株生化试验结果差异较大,TRB-12、TRB-20 及 TRB-27 都是隶属于 Flavobacterium属,TRB-20和 TRB-27的 V-P试验呈阴性,而菌株TRB-12呈阳性,在明胶液化试验中,TRB-12和TRB-27呈阳性,TRB-20呈阴性.
表2 天山1号冰川融水细菌菌株的生化生理特性及产酶性能
Table2 Physiological characteristics and enzyme activity of bacterial strains isolated from the meltwater of the Glacier No.1 in Tianshan Mountains
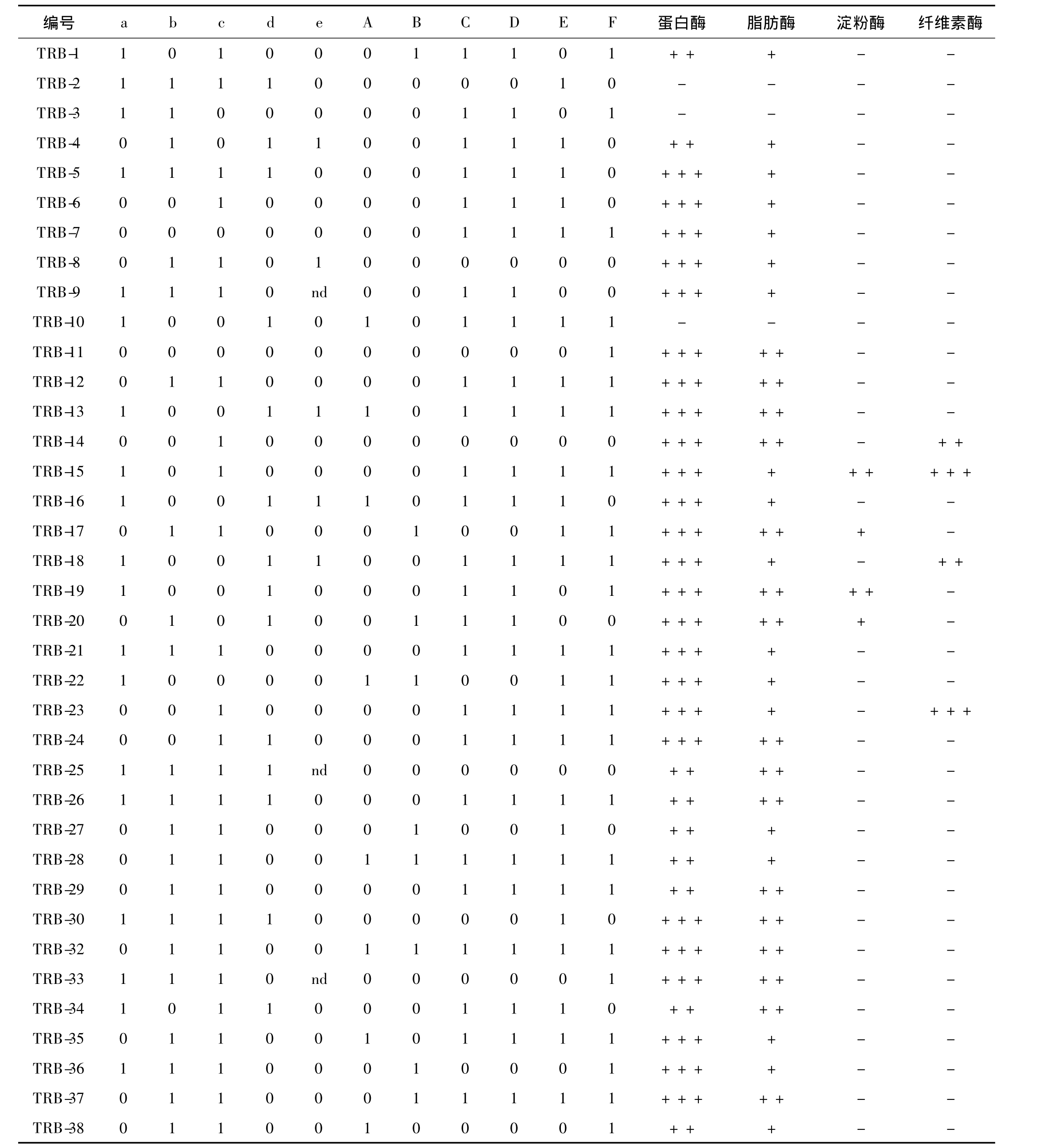
注:a硝酸盐还原试验;b接触酶试验;c明胶液化试验;d V-P;e M.R;A乳糖;B木糖醇;C果糖;D葡萄糖;E蔗糖;F麦芽糖;1阳性;0阴性;nd不能确定;+低酶活;++中等酶活;+++高酶活;-无酶活
分离菌株进行了常见的6种碳源利用试验可知,分离菌株对碳源的利用是不同的,而且同一属的菌株对碳源的利用差异也很大.多数菌株可以利用果糖、葡萄糖、蔗糖和麦芽糖,而只有个别菌株能利用半乳糖和木糖醇.Pseudomonas属对碳源的利用率较低,其中,TRB-25、TRB-8 和 TRB-14 不利用6种碳源,只有TRB-1能够利用半乳糖;同属Pseudomonas的 TRB-10 和 TRB-34 不能利用木糖醇,但可以利用果糖、蔗糖和麦芽糖,而TRB-10可以利用葡萄糖,TRB-34 不能.TRB-16 和TRB-22同属Flavobacterium,它们对碳源的利用截然相反,TRB-16不利用木糖醇、葡萄糖和麦芽糖,而TRB-22则相反;隶属Flavobacterium的TRB-11只能利用麦芽糖.隶属Microbacterium属的TRB-28菌株除了不能利用葡萄糖,可利用其余5种碳源.
2.5 药敏试验
根据NCCLS对实验进行详细分析发现(图4),36株分离菌株对萘啶酸耐药,97.2%的菌株对氯霉素、利福平、红霉素及杆菌肽4种抗生素有抗性,94.4%的菌株对头孢噻亏和青霉素有抗性;分离菌株对链霉素、四环素和新霉素3种抗生素有不同程度的耐药和敏感.隶属于Pseudomonas的分离菌株对萘啶酸和红霉素产生耐药,而部分菌株对链霉素和四环素敏感,其中,TRB-6和TRB-8对所选的10种抗生素均耐药,TRB-5和TRB-26对四环素、青霉素、氯霉素产生耐药,而TRB-33对其敏感.隶属Flavobacterium的部分菌株对链霉素、四环素及新霉素敏感,而对其他7种抗生素均耐药,其中,TRB-12、TRB-21、TRB-22、TRB-30、TRB-29 对 10种抗生素都产生耐药作用,仅TRB-26对链霉素、四环素及新霉素敏感;TRB-27对四环素和新霉素敏感,对链霉素耐药,而TRB-18、TRB-19则相反.隶属于Pedobacter的菌株TRB-24仅对链霉素和四环素中敏感,而对其余抗生素耐药.Janthinobacterium对链霉素、四环素、头孢噻亏敏感,对杆菌肽、青霉素萘啶酸有抗性,其中,菌株TRB-36、TRB-7对链霉素、四环素及新霉素敏感,而TRB-38则对其耐药.其中,菌株TRB-37对链霉素和新霉素敏感,对四环素和新霉素耐药,隶属Cytophaga sp.的菌株TRB-32则相反.Microbacterium sp.仅对四环素和新霉素中度敏感,而对其他药物具有抗性.
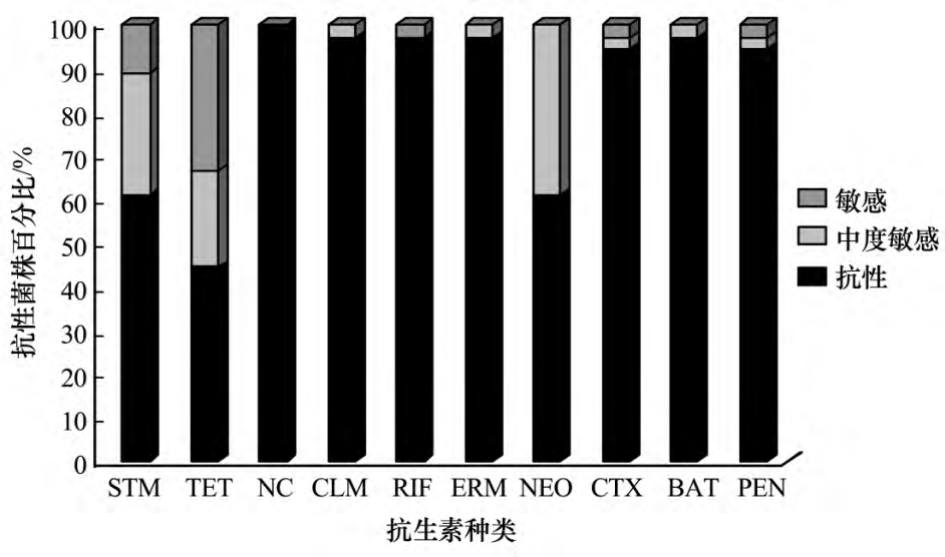
图4 天山1号冰川融水细菌菌株对不同抗生素的敏感性
Fig.4 Sensitivities of the bacterial strains isolated from the meltwater of the Glacier No.1 in Tianshan Mountains to various antibiotics
链霉素(STM)、四环素(TET)、萘啶酸(NC)、氯霉素(CLM)、利福平(RIF)、红霉素(ERM)、新霉素(NEO)、头孢噻肟(CTX)、杆菌肽(BAT)、霉素(PEN)
2.6 菌株产酶活性
36株分离菌株的产酶实验表明,除了菌株TRB-2、TRB-3 和 TRB-10,其他所有株菌均产蛋白酶和脂肪酶;产淀粉酶的菌株包括TRB-15、TRB-17、TRB-19、TRB-20,产纤维素酶的菌株有 TRB-14、TRB-15、TRB-18、TRB-23.依据菌落水解圈直径大小,显示大部分菌株产蛋白酶透明圈直径都在30mm左右,最大为35mm;产脂肪酶的透明圈直径平均在12mm左右,最大为16mm;而纤维素酶和淀粉酶的圈直径在22mm和15mm左右,说明菌株产蛋白酶的活性普遍较高.此外,统计显示,同一株菌可以产生多种胞外酶,例如菌株TRB-14、TRB-18、TRB-23同时分泌蛋白酶、脂肪酶和纤维素酶,但都不产淀粉酶;而菌株 TRB-17、TRB-19、TRB-20可以同时产脂肪酶、蛋白酶和淀粉酶,但不分泌纤维素酶;只有菌株Pseudomonas sp.TRB-15可同时分泌4种酶.
3 讨论与结论
冰川表面融水会携带表面冰层、冰尘、积雪中的微生物通过冰川表面的锅穴、裂隙到达冰川底部,因此,冰川末端融水径流中的细菌多样性不仅受到冰川下冰、水、岩沉积层以及孔隙水中的微生物影响,也受到冰川表面冰层、冰尘、积雪中的微生物以及冰川周边雨水中的微生物的影响[26].根据文献报道,冰川冰芯、融水及冻土等低温环境中,可培养细菌主要包括6个系统发育类群:α-Proteobacteria、β-Proteobacteria、γ-Proteobacteria、高G+C革兰氏阳性菌、Bacteroidetes、低G+C革兰氏阳性菌,至少有 30 多个属[10,21,27].最近采用克隆文库法对极地冰川表面研究显示,Proteobacteria占绝对优势,其中,α-Proteobacteria是最优势的类群[27],但采用分离培养方法显示 Actinobacteria占据优势[28].本研究分离培养结果表明,γ-Proteobacteria和Bacteroidetes是优势类群,而隶属于Actinobacteria的菌株数量很少,只分离到一株与Microbacterium oxydans 16S rRNA基因序列同源性为100%的菌株(TRB-28).
研究显示,天山1号冰川融水中分离到的菌株大部分是耐冷菌,只有少量是真正的嗜冷菌,这与其他冰川融水径流和生境(冰芯、冰尘洞及积雪)中的研究结果基本一致.其中TRB-7、TRB-20等菌株在37℃也可以生长,很可能是来自大气环流而沉降在冰川表面的外源细菌,在低温环境下长期适应的结果[7,9,29].嗜冷细菌在进化中形成了一系列适冷的机制,如产生冷激蛋白、增加胞质内多糖[30-31],以及各种色素、多糖夹膜等[4,7].在本研究中,发现Flavobacterium属的可培养菌株数量较多,对天山1号冰川生境的高通量测序结果显示,隶属于Flavobacterium的序列占冰川融水、底部沉积层文库总数的五分之一(数据另撰文列出).有文献报道,Flavobacterium属的细菌大多可以产生各种色素,普遍认为这些色素有利于细菌适应极端的低温环境和温度的频繁波动[32].本研究分离的70%Flavobacterium菌株均可以分泌色素形成不同颜色的菌落,但目前对这些细菌在冰川中发挥的生态学作用还了解的很少,有待深入研究.同样,研究结果显示,隶属于γ-Proteobacteria的 Pseudomonas属的可培养物数量最多(39%),且几乎全是耐冷菌,但是1号冰川融水、底部沉积层、积雪、表面冰尘的高通量测序的文库中,隶属于Pseudomonas属的reads数量占总序列的不足1%,甚至更低,采用克隆文库法不能检测到(数据另撰文列出).我们推测,Pseudomonas属的大多数细菌很可能来自外源的富营养环境,在寡营养的冰川极端生境中很可能处于休眠态,但在相对不算寡营养的TSB、R2A等培养基上恢复生长更容易形成菌落,而真正的寡营养细胞在普通的富营养培养基上很难得到纯培养物,这个假设在后续的研究中需要进一步证实.
低温微生物之所以能够在冰川环境下生存的另外一个原因是,它们可以产生多种有低温活性的胞外酶,这些酶在低温环境有机质的化学循环中发挥着重要的生态作用,在生物技术、食品、医药、纺织、污染物降解等领域有着潜在的开发价值[33-35].我们前期研究发现,天山1号冰川沉积层中产蛋白酶的菌株主要来自γ-Proteobacteria的Pseudomonas和 Actinobacteria的 Arthrobacter[33];产脂肪酶菌株大多也是Pseudomonas spp.菌株,其次是红球菌(Rhodococcus)和短波单胞菌(Brevundimonas)[34].对北极冰尘细菌多样性及适冷酶活性的研究结果表明,隶属于 Pseudomonas、Polaromonas、Micrococcus、Cryobacterium的细菌菌株大多具有多重酶活性,同时分泌蛋白酶、脂肪酶、淀粉酶及纤维素酶4种酶,其中,隶属于Cryobacterium的MLB-32菌株多重酶活性最高[35].本研究统计结果表明,除了菌株 Pseudomona TRB-2、TRB-3 和 TRB-10 没有产酶特性外,隶属于 α-Proteobacteria、β-Proteobacteria、Bacteroidetes的其他菌株均有产蛋白酶和脂肪酶的特性,其中,隶属于Pseudomonas sp.TRB-15同时具有4种酶活性,菌株Pseudomonas sp.TRB-14 和 Flavobacterium sp.TRB-18、TRB-23 同时具有蛋白酶、脂肪酶及纤维素酶活性,而同属于Flavobacterium的菌株 TRB-17、TRB-19、TRB-20具有蛋白酶、脂肪酶及淀粉酶活性.因此,微生物产胞外酶普遍不具有种属专一性,菌株的产酶性状与其系统发育之间并没有明显的对应规律,而表现为菌株依赖性,且大多菌株具有多重酶活性.此外发现,不产酶菌株的最大耐盐度一般不超过6%,而产酶菌株的耐盐性明显较高(8%~10%)(表1),说明天山1号冰川末端融水部分菌株可能来自冰川底部的沉积层,具有轻度嗜盐特性,但嗜冷菌株的产酶性状与其耐盐性是否有关,目前没有文献报道[30].
多重耐药性(multiple resistance,MDR)是指细菌菌株同时对多种结构的不同抗微生物药物产生耐药性.冰川细菌的耐药性最近受到关注,是因为一般认为冰川生境很少受到人类活动的影响,冰川生境的细菌很适合揭示原始生境中微生物的固有耐药谱[36].研究结果显示,冰川融水分离菌株对不同抗生素的敏感性差异较大,总体上冰川融水细菌对抗生素存在明显的耐药性.如Pseudomona菌株TRB-6、TRB-8 和Flavobacterium 菌株TRB-12、TRB-21、TRB-22、TRB-30、TRB-29 以及 Janthinobacterium菌株TRB-38对所有抗生素耐药.此外,虽然菌株TRB-33、TRB-6 都隶属于 Pseudomonas,但前者敏感性很强,而后者敏感性很弱,显示抗生素敏感性特征也没有种、属专一性属.我们前期检测了天山1号冰川沉积层产β-半乳糖苷酶菌株的耐药性,其结果与本研究结果相似[37].最近有人对南、北极冰川生境细菌抗生素抗性研究结果表明,冰川生境细菌普遍携带耐药性基因,研究者认为地理空间隔离很大的原始生境,细菌抗生素抗性基因的存在可能是通过空气扩散或者候鸟长距离迁徙携带了耐药细菌等因素传播[38].冰川细菌产生多重耐药性的一种解释是冰川环境中本身可能存在抗生素抗性基因的水平转移,另一种解释是多重耐药性菌株来自远古的非冷冻环境[39].因此,对冰川细菌多重耐药性进化历史、现状及其产生机理非常有必要开展更广泛的研究工作.
此外,鉴于冰川融水径流微生物多样性受到冰川下冰、水、岩沉积层以及孔隙水微生物的影响,冰川底部沉积层中起主导作用的固有微生物很可能是厌氧的无机自养菌,尤其是介导碳、氮、硫代谢的活性功能微生物类群,分离得到无机自养的纯培养物将有助于我们更深入了解冰川微生物多样性与其介导的生物地球化学作用.
参考文献(References):
[1]Xiang Shurong,Yao Tandong,Chen Yong,et al.Progresses of community distribution of microorganisms in glacier[J].Acte Ecologic Sinica,2006,26(9):3098-3107.[向述荣,姚檀栋,陈勇,等.冰川微生物菌群分布的研究概况及其前景[J].生态学报,2006,26(9):3098-3107.]
[2]Margesin R,Zacke G,Schinner F.Characterization of heterotrophic microorganisms in Alpine glacier cryoconite[J].Arctic,Antarctic,and Alpine Research,2002,34(1):88-93.
[3]Mueller D R,Vincent W F,Fritsen C H,et al.Glacial cryoconite ecosystems:A bipolar comparison of algal communities and habitats[J].Nova Hedwigia Beiheft,2001(123):173 -197.
[4]Christner B C,Kvitk B H,Reev J N.Molecular identification of bacteria and eukarya inhabiting an Antarctic cryoconite hole[J].Extremophiles,2003,7(3):177 -183.
[5]Säwström C P,Mumford W,Marshall A,et al.The microbial communities and primary productivity of cryoconite holes in an Arctic glacier(Svalbard 79°N)[J].Polar Biology,2002,25(8):591-596.
[6]Stibal M,Šabacká M,Kaštovská K.Microbial counities on glacier surfaces in Svalbard:Impact of physical and chemical properties on abundance and structure of cyanobacteria and algae[J].Microbiology Ecology,2006,52(4):644 -654.
[7]Foght J,Aislabie J,Turner S,et al.Culturable bacteria in subglacial sediments and ice from two southern hemisphere glaciers[J].Microbiology Ecology,2004,47(4):329 -340.
[8]Willerslev E,Hansen A J,Christen B,et al.Diversity of holocene life forms in fossil glacier ice[J].Proceeding of the National Academy Sciences USA,1999,96(14):8017-8021.
[9]Christner B C,Mosley-Thompson E,Thompson L G,et al.Recovery and identification of viable bacteria immured in glacial ice[J].Icarus,2000,144(2):479 -485.
[10]Wu Xiukun,Mao Wenliang,Tai Xisheng,et al.Progress in studies of microbial ecology in glacier foreland[J].Joural of Glaciology and Geocryology,2013,35(1):217-223.[伍修锟,毛文梁,台喜生,等.冰川前沿裸露地微生物生态学研究进展[J].冰川冻土,2013,35(1):217-223.]
[11]Zhang Gaosen,Zhang Wei,Liu Guangxiu,et al.Distribution of aerobic heterotrophic bacteria managed by environment factors in glacier foreland[J].Journal of Glaciology and Geocryology,2012,34(1):965-971.[章高森,张威,刘光琇,等.环境因素主导着冰川前沿裸露地好氧异样细菌群落的分布[J].冰川冻土,2012,34(1):965-971.]
[12]Xiang Shurong,Yao Tandong,An Lizhe,et al.Vertical quantitative and dominant population distribution of the bacteria isolated from the Muztagata ice core[J].Science in China(Series D),2005,48(10):1728-1739.[向述荣,姚檀栋,安黎哲,等.慕士塔格冰芯可培养细菌的数量分布和主要菌群结构随深度的变化[J].中国科学(D 辑),2005,35(3):252-262.]
[13]Lin Juan,Zhang Xinfang,An Lizhe,et al.Study of the diversity and depth distribution of bacteria isolated from the core of the Glacier No.1 at the headwaters of the Ürümqi River,Tianshan Mountains[J].Journal of Glaciology and Geocryology,2008,30(6):1033-1040.[林娟,张新芳,安黎哲,等.天山冰芯细菌多样性研究[J].冰川冻土,2008,30(6):1033-1040.]
[14]Yao Tandong,Liu Yongqin,Kang Shichang,et al.Bacteria variabilities in a Tibetan ice core and their relations with climate change[J].Global Biogeochemical Cycles,2007,22(10):1029-1038.
[15]Li Zhongqin,Han Tianding,Jing Zhefan,et al.Summary of 40-year observed variation facts of climate and Glacier No.1 at headwater of Ürümqi River,Tianshan,China[J].Journal of Glaciology and Geocryology,2003,25(2):117-123.[李忠勤,韩添丁,井哲帆,等.乌鲁木齐河源区气候变化和1号冰川40 a观测事实[J].冰川冻土,2003,25(2):117-123.]
[16]Wang Shengjie,Zhang Mingjun,Li Zhongqin,et al.Glacier area variation and climatechangein theChinese Tianshan Mountains since 1960[J].Journal of Geographical Sciences,2011,21(2):263-273.
[17]Steven B,Pollard W H,Greer C W,et al.Microbial diversity and activity through a permafrost/ground ice core profile from the Canadian high Arctic[J].Environmental Microbiology,2008,10(12):3338-3403.
[18]Gu Yanling,Shi Xuewei,Zhu Jianbo,et al.Vertical distribution pattern of the archaea community within the permafrost active layer in front of the Glacier No.1 at headwaters of Ürümqi River,Tianshan Mountains[J].Journal of Glaciology and Geocryology,2013,35(3):761-769.[顾燕玲,史学伟,祝建波,等.天山乌鲁木齐河源1号冰川前沿冻土活动层古细菌群落的垂直分布格局[J].冰川冻土,2013,35(3):761-769.]
[19]Bai Yu,Yang Daqun,Wang Jianhui,et al.Phylogenetic diversity of culturable bacteria from alpine permafrost in the Tianshan Mountains,northwestern China[J].Research in Microbiology,2006,157(8):741-751.
[20]Liu Yongqin,Yao Tandong,Jiao Nianzhi,et al.Microbial diversity in the snow,a moraine lake and a stream in Himalayan glacier[J].Extremophiles,2011,15(3):411 -421.
[21]Miteva V I,Sheridan P P,Brenchley J E.Phylogenetic and physiological diversity of microorganisms isolated from a deep Greenland glacier ice core[J].Applied and Environmental Microbiology,2004,70(1):202-213.
[22]Saitou N,Nei M.The neighbor-joining method:A new method for reconstructing phylogenetic trees[J].Molecular Biology and Evolution,1987,4(4):406-425.
[23]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[24]Dong Xiuzhu,Cai Miaoying.Systematic Identification Manual for Common Bacteria[M].Beijing:Science Press,2001:364-398.[东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:364-398.]
[25]Coleman D C,Pomeroy H,Estridge J K,et al.Susceptibility to antimicrobial agents and analysis of plasmids in gentamic-and methicillin-resistant Staphylococcus aureus from Dublin hospitals[J].Journal of Medical Microbiology,1985,20(2):157 -167.
[26]Sheng Yongping,Liang Hong.Global ice melting accelerated would threaten to human environmental safety[J].Journal of Glaciology and Geocryology,200l,23(2):208 -211.[沈永平,梁红.全球冰川消融加剧使人类环境面临威胁[J].冰川冻土,200l,23(2):208 -211.]
[27]Zeng Yinxin,Yan Ming,Yu Yong,et al.Diversity of bacteria in surface ice of Austre Lovénbreen glacier,Svalbard[J].Archives of Microbiology,2013,195(5):313-322.
[28]Liu Yongqin,Yao Tandong,Jiao Nianzhi,et al.Culture bacteria in glacial meltwater at 6350 m on the East Rongbuk Glacier,Mount Everest[J].Extremophiles,2009,13(1):89 -99.
[29]Cheng S M,Foght J M.Cultivation-independent and -dependent characterization of bacteria resident beneath John Evans Glacier[J].FEMS Microbiology Ecology,2007,59(2):318 -330.
[30]Fong N,Burgess M,Barrow K,et al.Carotenoid accumulation in the psychrotrophic bacterium Arthrobacter agilis in response to thermal and salt stress[J].Applied Microbiology and Biotechnology,2001,56(5/6):750-756.
[31]De Fede K L,Sexstone A J.Differential response of size fractionated soil bacteria in BIOLOG ® microtitre plates[J].Soil Biology and Biochemistry,2001,33(11):1547-1554.
[32]Ma Xiaojun,Liu Wei,Hou Shugui,et al.Bacterial diversity and community at Yulong Mountains and their relationship to climatic and environmental changes[J].Journal of Lanzhou University(Natural Sciences),2009,45(6):94-100.[马晓军,刘炜,侯书贵,等.玉龙雪山冰川雪坑中细菌多样性群落结构及其与气候环境的关系[J].兰州大学学报(自然科学版),2009,45(6):94 -100.]
[33]Ni Yongqing,Gu Yanling,Shi Xuewei,et al.Phylogenetic and physiological diversity of cold-adapted bacteria producing protease from sediments of the bottom layer of the Glacier No.1 in the Tianshan Mountains[J].Acta Microbiologica Sinica,2013,53(2):164-172.[倪永清,顾燕玲,史学伟,等.天山1号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育[J].微生物学报,2013,53(2):164-172.]
[34]Xu Yuli,Wang Dawei,Ni Yongqing,et al.Selective isolation and diversity of cold-adapted lipase-producing strains from permafrost soil at the terminus ofa glacier in the Tianshan Mountains[J].Acta Microbiologica Sinica,2013,53(2):164-172.[徐宇丽,王大伟,倪永清,等.天山冻土产低温脂肪酶菌株的筛选及其多样性分析[J].微生物学报,2011,53(2):233 -240.]
[35]Singh P,Singh S M,Dhakephalkar P.Diversity,cold active enzymes and adaptation strategies of bacteria inhabiting glacier cryoconite holes of High Arctic[J].Extremophiles,2014,18(2):229-242.
[36]Sjölund M,Bonnedahl J,Hernandez J,et al.Dissemination of multidrug-resistant bacteria into the Arctic[J].Emerging Infectious Diseases,2008,14(1):70 -72.
[37]Zhang Ming,Gu Yanling,Ni Yongqing,et al.Phylogenetic and physiological diversity of cold-adapted bacteria producing β-galactosidase from permafrost sediments of the bottom layer of the Glacier No.1 in the Tianshan Mountains[J].Acta Microbiologica Sinica,2011,51(12):1605-1615.[张明,顾燕玲,倪永清,等.天山1号冰川底部沉积层产β-半乳糖苷酶低温菌株的系统发育分析及生理多样性[J].微生物学报,2011,51(12):1605 -1615.]
[38]Segawa T,Takeuchi N,Rivera A,et al.Distribution of antibiotic resistance genes in glacier environments[J].Environmental Microbiology Reports,2013,5(1):127 -134.
[39]Martinez J L.Natural antibiotic resistance and contamination by antibiotic resistance determinants:The two ages in the evolution of resistance to antimicrobials[J].Frontiers in Microbiology,2012(3):1.doi:10.3389/fmicb.2012.00001.
Cultivable bacteria isolated from the meltwater of the Glacier No.1 at headwater of the Ürümqi River in Tianshan Mountains:Physiological-biochemical characteristics and phylogeny
Abstract:In this study,it is aimed to characterize the physiological and phylogenetic diversity of bacteria isolated from the meltwater of the Glacier No.1 at headwater of the Ürümqi River in Tianshan Mountains,China.Using culture medium of R2A,10%and full strength tryptic soy agar,a total of 36 aerobic bacteria strains were isolated from the meltwater of the Glacier No.1.Phenotypic characteristics of the isolated strains were examined,including the tolerance to NaCl,temperature range for growth,enzyme activity and antibiotic resistance.16S rRNA gene sequence analysis and microscopy indicated that the isolated strains were dominated by Gram-negative bacteria.Based on 16S rRNA gene sequences,it is found that the isolates are members of α,β and γ of Proteobacteria,Actinobacteria and Bacteroides group.The most abundant and diverse isolates are within the Bacteroidetes(41.7%)and γ-Proteobacteria(38.9%).More than one-third of the isolates could be tentatively identified as Pseudomonas spp.According to the temperature range for growth,it is believed that most of the isolates(80%)are psychrotrophic ones.Among 36 isolates,seven are resistant to all antibiotics.In addition,thirty-three isolates have potentially useful cold-active enzymes,including those with proteolytic,amylolytic,lipolytic,and cellulose-hydrolyzing activities.The results will enrich the knowledge of the phylogenetic and physiological diversity of cold-adapted strains in cold environments.
Key words:Tianshan Mountains;Glacier No.1 at headwater of the Ürümqi River;meltwater;phylogeny;coldadapted enzyme;drug resistance
中图分类号:Q938.1
文献标志码:A
文章编号:1000-0240(2015)02-0511-11
doi:10.7522/j.issn.1000-0240.2015.0058
Tao Ling,Gu Yanling,Zheng Xiaoji,et al.Cultivable bacteria isolated from the meltwater of the Glacier No.1 at headwater of the Ürümqi River in Tianshan Mountains:Physiological-biochemical characteristics and phylogeny[J].Journal of Glaciology and Geocryology,2015,37(2):511 -521.[陶玲,顾燕玲,郑晓吉,等.天山乌鲁木齐河源1号冰川融水可培养细菌生理生化特性及其系统发育[J].冰川冻土,2015,37(2):511-521.]
收稿日期:2014-10-22;
修订日期:2015-03-03
基金项目:国家自然科学基金项目(40961002;41140009;41271268);中国科学院寒区旱区环境与工程研究所冻土工程国家重点实验室开放基金项目(SKLFSE200903);中国博士后科学基金(20100339)资助
*通讯作者: 倪永清,E-mail:niyqlzu@sina.com.
