天山一号冰川产淀粉酶酵母菌的筛选及其系统发育分析
【类型】期刊
【作者】刘敏瑞,李瑞琴,倪永清(石河子大学食品学院)
【作者单位】石河子大学食品学院
【刊名】安徽农业科学
【关键词】 天山冰川;酵母菌;低温淀粉酶;系统发育
【资助项】国家自然科学基金项目;新疆兵团博士资金专项
【ISSN号】0517-6611
【页码】P11095-11096
【年份】2019
【期号】第31期
【摘要】[目的]筛选并分析天山一号冰川冰层产淀粉酶的低温酵母菌。[方法]对天山一号冰川冰层含冰冻土产低温淀粉酶的低温酵母菌菌株进行筛选、纯化,并对其生理多样性和系统发育多样性进行研究。[结果]从天山一号冰川冰层含冰冻土中分离出60株酵母菌,并从中筛选出6株产低温淀粉酶的菌株,根据细胞菌落形态、菌体特征和26S rDNA D1/D2区域序列系统发育分析,6株菌分别隶属于红酵母属(Rhodotorula)、隐球菌属(Cryptococcus)和掷孢酵母属(Sporobolomyces),最适生长温度为20~24℃,为兼性耐冷细菌。[结论]研究可为了解冰川酵母菌的系统发育多样性以及低温淀粉酶的生物技术研发奠定基础。
【全文】 文献传递
天山一号冰川产淀粉酶酵母菌的筛选及其系统发育分析
摘要 [目的]筛选并分析天山一号冰川冰层产淀粉酶的低温酵母菌。[方法]对天山一号冰川冰层含冰冻土产低温淀粉酶的低温酵母菌菌株进行筛选、纯化,并对其生理多样性和系统发育多样性进行研究。[结果]从天山一号冰川冰层含冰冻土中分离出60株酵母菌,并从中筛选出6株产低温淀粉酶的菌株,根据细胞菌落形态、菌体特征和26SrDNA D1/D2区域序列系统发育分析,6株菌分别隶属于红酵母属(Rhodotorula)、隐球菌属(Cryptococcus)和掷孢酵母属(Sporobolomyces),最适生长温度为20~24℃,为兼性耐冷细菌。[结论]研究可为了解冰川酵母菌的系统发育多样性以及低温淀粉酶的生物技术研发奠定基础。
关键词 天山冰川;酵母菌;低温淀粉酶;系统发育
地球生物圈3/4属于永久低温环境,包括南北两极及环极地地区、深海海水、高原高山地区[1]。低温环境中微生物分泌的胞外酶在中、低温度下具有较高催化活性,在工农业和生物技术等领域有广泛的应用价值[2]。因此,低温微生物及低温酶的冷适应机制研究成为当前的一个热点。淀粉酶是水解淀粉及糖原的酶类总称[3],是重要的工业用酶,应用于食品、洗涤、饲料、制药、纺织和造纸等工业。低温淀粉酶在生物工程领域及解决现代能源危机中有着广泛的应用前景。目前,国外主要针对南极冰川可培养的低温酵母菌多样性的研究较多[4],但对酵母菌产酶性能的研究较少。我国关于低温酵母菌及其产淀粉酶的研究报道大多来自海洋深水处[5],对其他冷生境中酵母菌的研究很少。笔者对天山一号冰川冰层含冰冻土产低温淀粉酶的低温酵母菌菌株进行筛选、纯化,并对其生理多样性和系统发育多样性进行研究,为低温淀粉酶在工农业及食品生物技术各领域的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 原料。冻土样品于2012年9月采自天山一号冰川西支的冰川尾部,海拔3 833 m(43°07.125N,86°48.707E)。
1.1.2 主要试剂。PCR扩增所用全套试剂、引物均购自TaKaRa公司,其余试验所用试剂均为进口或国产分析纯。
1.1.3 主要仪器。PCR 扩增仪 Tpersonal,德国 Biometra;水平电泳仪PowerPac Universal,德国BioRad;凝胶成像系统Gel DocTM XR,德国BioRad;紫外-可见光分光光度计Ultrospec 5300 pro,美国 GE Healthcare。
1.1.4 培养基。分离培养基RB(Rose Bengal agar)+tetracycline 培养基[6],琼脂 1.5%;液体富集培养基 YEPG(酵母提取物10 g/L,peptone 10 g/L,葡萄糖20 g/L);基础培养基YEPG(酵母提取物10 g/L,peptone 10 g/L,葡萄糖20 g/L),琼脂粉1.5%;选择培养基(酵母提取物10 g/L,peptone 10 g/L,可溶性淀粉2%),琼脂粉1%;以上培养基pH均为6.8,121℃灭菌20 min。
1.2 菌株的分离与纯化 富集培养,10℃培养48 h,使菌种增殖。采用梯度稀释平板涂布法于分离培养基上进行分离。10℃培养7 d,转接划线培养3次后,根据菌落颜色、大小、形态等表型差异进行初步分离筛选并纯化,所得纯培养物转接到YEPG基础斜面培养基上,编号,4℃保藏备用。
1.3 产低温淀粉酶菌株筛选 在选择培养基上培养分离的低温菌株,24℃培养3 d后在培养基表面分别滴加稀碘液,观察菌落周围是否有透明圈产生。
1.4 菌株最适生长温度测定 将6株产淀粉酶酵母菌株接入YEPD液体富集培养基(pH为6.0)中,分别在16、20、24、28、37℃ 5个温度下培养,培养48 h后600 nm测OD值。
1.5 26Sr DNA基因的PCR扩增和系统进化分析 提取单菌落的DNA,采用酵母菌26S rDNA基因通用引物NL1和NL4扩增26SrDNAD1/D2区基因片段[7]。反应条件:95℃预变性5 min,36次循环(94℃变性40 s,55℃复性40 s,72℃延伸30 s),最后72℃延伸10 min。PCR产物用EZ-10 column PCR Product Purification kit纯化后,由上海生工生物科技有限公司直接测序。所得序列提交到GenBank数据库,用BLAST进行相关序列搜索,CLUSTAL X 1.83软件对齐序列,采用邻接法neighbor-joining和MEGA4.1软件构建进化树,进化树分支的置信度采用bootstrap法,重复次数为1 000[8]。
2 结果与分析
2.1 酵母菌的分离纯化及产酶菌株的筛选结果 从天山一号冰川冰层含冰冻土中共分离纯化到60株酵母菌菌株,从中筛选到6株产低温淀粉酶的菌株,编号分别为C9、L1、L15、L18、L27、L34。
2.2 菌种形态与菌体特征鉴定结果 筛选培养基上培养48 h后观察其菌落形态和菌体特征,结果如表1。
表1 酵母菌形态学观察结果
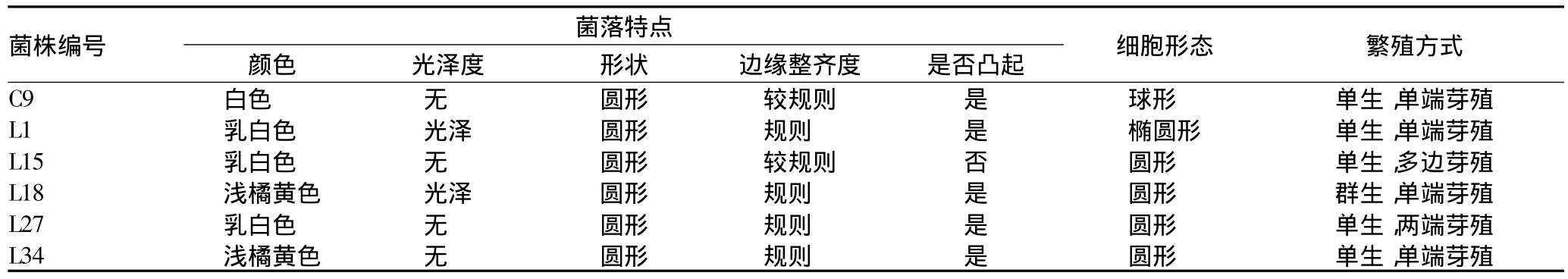
菌株编号 菌落特点 细胞形态 繁殖方式C9 白色 无 圆形 较规则 是 球形 单生,颜色 光泽度 形状 边缘整齐度 是否凸起单端芽殖L1 乳白色 光泽 圆形 规则 是 椭圆形 单生,单端芽殖L15 乳白色 无 圆形 较规则 否 圆形 单生,多边芽殖L18 浅橘黄色 光泽 圆形 规则 是 圆形 群生,单端芽殖L27 乳白色 无 圆形 规则 是 圆形 单生,两端芽殖L34 浅橘黄色 无 圆形 规则 是 圆形 单生,单端芽殖
2.3 产低温淀粉酶酵母菌株的最适生长温度 试验结果(图1)表明,菌株 L1、L15、L18、L34的的最适生长温度范围均在24℃左右,属于耐冷菌,菌株C9、L27的最适生长温度在16℃左右,属于嗜冷菌[9]。而且温度低于或高于最适温度,菌悬液OD值都有所降低,表明菌株生长受到抑制;6种菌株中C9菌株的耐低温效果最好。
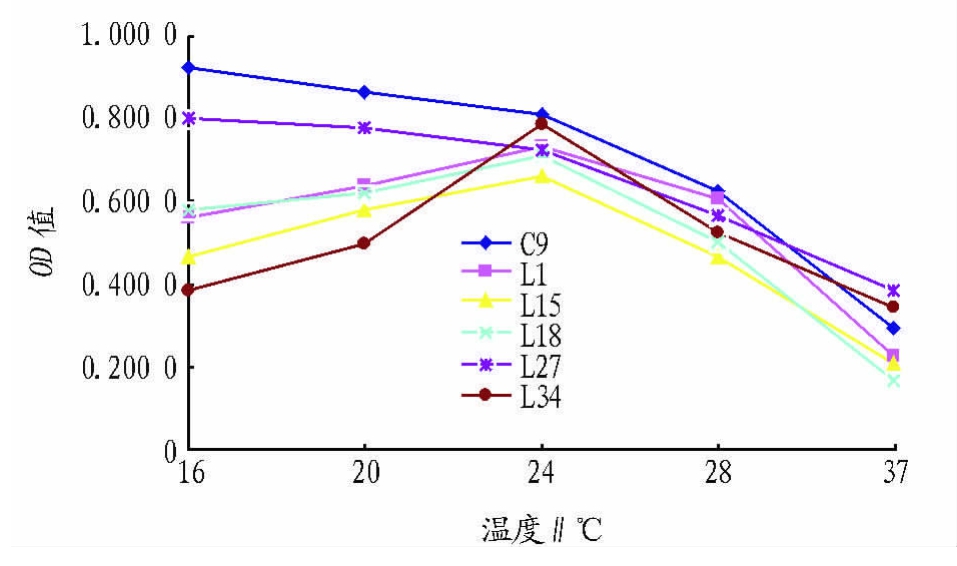
图1 6株产淀粉酶酵母菌株最适生长温度
2.4 26Sr DNA基因扩增和系统发育分析 从天山一号样品中筛选到6株产低温淀粉酶的酵母菌株,基于26SrDNA D1/D2区域序列构建的系统发育树如图2。由图2可知,6株产低温淀粉酶菌株分别属于 Rhodotorula、Cryptococcus、Sporobolomyces3个属。C9菌株与Cryptococcus sp.亲缘关系最近,相似性达99%,隶属于Cryptococcus属;L1、L18菌株与Rhodotorula sp.亲缘关系最近,相似性分别达到99%、98%,隶属于Rhodotorula属;L27菌株与Sporobolomycesroseusstrain亲缘关系最近,相似性达到99%,隶属于Sporobolomyces属;L34菌株与Sporobolomyces roseus strain的亲缘关系达到98%,属于Sporobolomyces属;L15与Rhodotorula sp.的亲缘关系最近,但是相似性只有86%,该菌株可能为红酵母属Rhodotorula,暂时鉴定为该属,有待进一步研究。
3 讨论
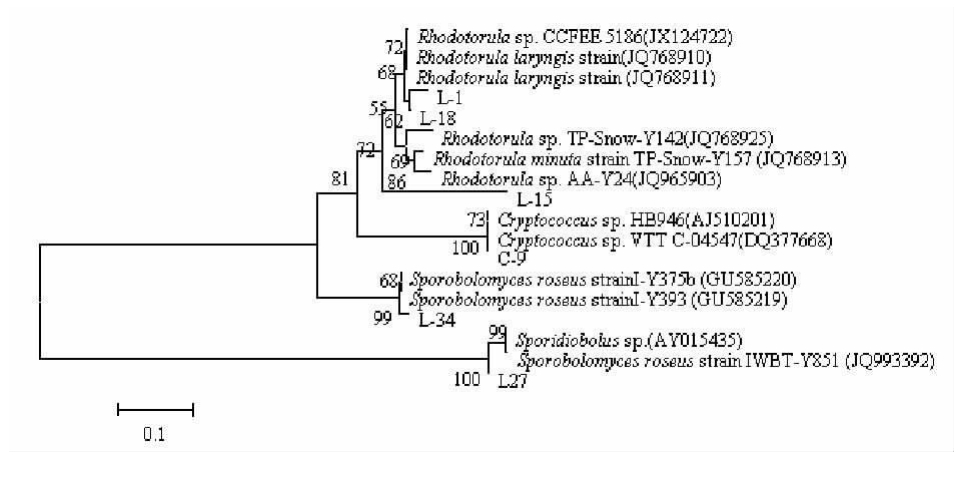
图2 基于26S r DNA序列的26株酵母菌株的系统发育树
淀粉酶广泛存在于动物、植物和微生物中[10],是一类非常重要的工业用酶,目前国内外市场中常用的淀粉酶一般都是中温或高温淀粉酶,最适酶活温度一般都在50℃左右,在0~20℃低温范围活力很低[11],不适于食品、饲料、纺织和洗涤剂、制药等低温处理的条件而限制其应用,但低温淀粉酶的最适酶活温度一般在40℃以下,因此其很好地解决了这一难题,具有中、高温淀粉酶无法取代的优越性。该试验从天山一号冰川冰层含冰冻土中分离、纯化出60株酵母菌菌株,筛选出6株产低温淀粉酶的酵母菌菌株,并对所分离的菌株进行较系统的分类鉴定,为低温淀粉酶的工业化生产奠定了一定的理论和实践基础,以解决酶来源的问题。到目前为止,尽管文献报道低温淀粉酶比中温酶有许多的优势,但低温酶生物技术的应用开发并不成熟,针对于冷环境中微生物资源的开发,还需在培养方法和技术上取得突破[2]。
参考文献
[1]MARGESINR,MITEVA V.Diversity and ecology of psychrophilic microorganisms[J].Research in Microbiology,2011,162(3):346 -361.
[2]MARGESIN R,SCHINNER F,MARX J C,et al.Psychrophiles:from biodiversity to biotechnology[M].Berlin Heidelberg:Springer,2008:347 -364.
[3]胡学智.国内外酶制剂工业及其应用[J].工业微生物,2001,31(3):41-46.
[4]李田,刘光绣,安黎哲.低温微生物的适冷特性研究进展及其应用前景[J].冰川冻土,2006,28(3):450 -455.
[5]王晓红,池振明.产淀粉酶海洋酵母菌的研究及鉴定[J].中国海洋大学学报,2007,37(2):5 -6.
[6]TURCHETTI B,BUZZINI P,GORETTI M,et al.Psychrophilic yeasts in glacial environments of Alpine glaciers[J].FEMS Microbiol Ecol,2008,63:73 -83.
[7]SUEL B,BORK P,HUYNEN M.Genome evolution:gene fusion versusgene fission[J].Trends Genet,2000,16(1):9 -11.
[8]程池,李金霞,姚粟,等.Biolog微生物自动分析系统在酿酒酵母鉴定中的应用[J].酿酒科技,2006,145(7):58 -64.
[9]MORITA R Y.Psychrophilic bacteria[J].Bacteriol Rev,1975,39:146 -166.
[10]钱海丰,赵晓娟,赵心爱.a-淀粉酶基因表达的调控[J].西北农业学报,2003,12(4):87 -90.
[11]MARGESIN R,SCHINNER F.Biodegradat ion of organic pollutant s at low temperatures[M]//Biot echnological Applications of Cold-adapted Organisms,Berlin;New York:Springer,1999:271 -289.
Phylogenic Analysis of Cold-adapted Yeasts Producing Amylase from Permafrost of the Glacier No.1 in the Tianshan Mountains
Abstract [Objective]To screen and analyze cold-adapted yeasts producing amylase from permafrost of the Glacier No.1 in the Tianshan Mountains.[Method]The screening and purification were conducted,physiological diversity and phylogenetic diversity were studied.[Result]The cold-adapted amylase-producing strains of yeasts was isolated from permafrost of the Glacier No.1 in the Tianshan Mountains.Among 60 selected and purified strains of yeasts,only 6 isolates were cold-adapted amylase-producing strains by using the screening media containing starch.Based on their phenotypes and 26SrDNA gene D1/D2 sequences,6 cold-adapted amylase-producing strains of yeasts belonged to 3 genera Rhodotorula,Cryptococcus and Sporobolomyces.Six isolates producing amylase showed the optimal growth temperature ranging from 20℃ to 24 ℃,indicating that they were psychrotrophic.[Conclusion]The results enrich our knowledge on the phylogenetic and physiological diversity of cold-adapted strains of yeasts producing amylase in cold environments.
Key words Tianshan Mountains;Yeast;Cold-adapted amylase;Bacterial phylogeny
中图分类号 S181+.4
文献标识码 A
文章编号 0517-6611(2014)31-11095-02
DOI:10.13989/j.cnki.0517-6611.2014.31.094
基金项目 国家自然科学基金项目(40961002,41140009,41271268);新疆兵团博士资金专项(2011BB009)。
收稿日期 2014-09-23
