天山一号冰川产蛋白酶酵母菌的筛选及其系统发育分析
【类型】期刊
【作者】赵有婷,孙海龙,刘敏瑞,于洋,倪永清(石河子大学食品学院)
【作者单位】石河子大学食品学院
【刊名】安徽农业科学
【关键词】 天山一号冰川;酵母菌;蛋白酶;系统发育
【资助项】国家自然科学基金项目(40961002,41140009,41271268)
【ISSN号】0517-6611
【页码】P248-250
【年份】2019
【期号】第1期
【摘要】[目的]筛选天山一号冰川底部沉积层耐低温的产蛋白酶菌株,研究其生理生化特性并做系统发育分析。[方法]以天山一号冰川底部沉积层中耐低温产蛋白的酵母菌株为材料,用Yeast Extract Peptone Dextrose Medium(YPD)培养基活化60株酵母菌;再用选择性培养基筛选产蛋白酶的菌株,观察菌落形态;测定产酶菌株最适温度;最后基于26S r DNA基因D1/D2区序列进行系统发育分析。[结果]从60株酵母菌中共筛选出10株产蛋白酶菌株,其中产酶优势菌为BCY-8、BCY-20,产酶酵母细胞平均大小为2.60~5.00μm,最适生长温度为24℃。经系统发育分析可知,10株产酶酵母菌属于隐球菌(Cryptococcus)、红酵母属(Rhodotorula)、南极酵母(Antarctic yeast)、Uncultured fungus、Mazocraeoides gonialosae。[结论]研究可为低温蛋白酶生物技术的研发奠定基础。
【全文】 文献传递
天山一号冰川产蛋白酶酵母菌的筛选及其系统发育分析
摘要:[目的]筛选天山一号冰川底部沉积层耐低温的产蛋白酶菌株,研究其生理生化特性并做系统发育分析。[方法]以天山一号冰川底部沉积层中耐低温产蛋白的酵母菌株为材料,用Yeast Extract Peptone Dextrose Medium(YPD)培养基活化60株酵母菌;再用选择性培养基筛选产蛋白酶的菌株,观察菌落形态;测定产酶菌株最适温度;最后基于26S r DNA基因D1/D2区序列进行系统发育分析。[结果]从60株酵母菌中共筛选出10株产蛋白酶菌株,其中产酶优势菌为BCY-8、BCY-20,产酶酵母细胞平均大小为2.60~5.00 μm,最适生长温度为24 ℃。经系统发育分析可知,10株产酶酵母菌属于隐球菌(Cryptococcus)、红酵母属(Rhodotorula)、南极酵母(Antarctic yeast)、Uncultured fungus、Mazocraeoides gonialosae。[结论]研究可为低温蛋白酶生物技术的研发奠定基础。
关键词:天山一号冰川;酵母菌;蛋白酶;系统发育
蛋白酶是水解蛋白质的一大类酶的通称,广泛存在于动物内脏、植物茎叶、植物果实和微生物中,自20世纪以来在食品、洗涤添加剂、饲料、造纸、制药等行业中的应用价值极高,占世界用酶市场60% 以上的份额[1-2]。目前,从低温微生物中筛选新的生物活性物质已成为新的研究热点[3-4]。低温酶是指在低温环境中也能拥有高催化活性且对高温敏感的一类酶,主要是由嗜冷菌(psychrophile)和耐冷菌(psychrotolerant)产生[4]。由于低温酶在低温环境下具有较高的酶活性,有助于在保证催化效率的前提下降低反应温度和缩短反应时间,从而大幅度节约能源[5]。天山冻土属于我国高海拔高山常年冻土,冻土环境中微生物会产生一系列适应低温、寡营养、强辐射、冻融等极端因子的分子机制,为低温微生物生理多样性提供了可能。而目前国内对有关高海拔低温蛋白酶菌株的研究报道较少[5-8],主要研究大多来自南极及南海深部沉积层。笔者对天山一号底部沉积层中产蛋白酶的酵母菌株进行了分离、筛选,并研究了其系统发育多样性,以期为低温蛋白酶生物技术的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和仪器。用于PCR扩增的全套试剂及扩增引物均购自TaKaRa公司,相关生理生化试验所用试剂均购自于天津市巴斯夫化学试剂厂及天津市致远化学试剂厂。高速冷冻离心机为Thermo 公司 Fresco21 型;PCR 仪为德国 Biometra 公司Tprofessional;凝胶成像系统为BioRad公司GelDOC XR;水平电泳仪为美国BioRad公司PowerPacUniversal、电泳槽 SUBCELL GT(20 cm×25 cm)。
1.1.2 培养基。YPD液体培养基:酵母膏10 g/L、蛋白胨20 g/L、葡萄糖20 g/L;葡萄糖过滤除菌,其他试剂高压灭菌。YPD培养基:酵母提取物10 g/L、葡萄糖20 g/L、琼脂20 g/L和酪蛋白20 g/L。YEPG培养基:YPD培养基加蛋白胨20 g/L。pH均为7.0,121 ℃灭菌20 min。
1.1.3 供试菌种。 石河子大学食品学院实验室从天山冻土带冻土样品中筛选鉴定所得的酵母菌。
1.2 菌株的活化与产蛋白酶菌株的筛选及菌落特征 用YPD液体培养基活化-80 ℃保藏的酵母菌,再用YEPG培养基16 ℃培养24 h筛选产蛋白酶的菌株,以有无菌落透明圈作为初筛依据[5]。最后在YPD固体培养基上划线,16 ℃培养1~7 d记录菌落特性。
1.3 酵母菌生长较适温度的测定 按5%的接种量将60株菌接种于10 ml YPD液体培养基中,分别在16、20、24、28、37 ℃培养。用紫外分光光度计在波长420、600 nm下每隔10 h测定一次吸光值,共测5次。
1.4 26S rDNA基因的扩增和系统进化分析 采用CTAB法提取酵母菌DNA,用NL1和NL4对酵母菌DNA进行26S rRNA基因扩增。反应体系(50 μl),dNTP 1.0 μl、Taq DNA 0.2 μl、引物各2.0 μl、Taq DNA聚合酶10×缓冲液5.0 μl、2×Taq MasterMix 25.0 μl、MgCl2(2 mmol/l)4.0 μl,最后用去离子水补足。PCR循环:95 ℃预变性5 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸30 s,循环次数36次,72 ℃延伸10 min。PCR 产物由上海生工生物科技有限公司直接测序。所得序列用BLAST进行相关序列搜索, CLUSTAL X 1.83[9] 软件对齐序列,采用邻接法neighbor-joining[10]和MEGA4.1[11]软件构建进化树,进化树分支的置信度采用bootstrap法,重复次数为1 000。
2 结果与分析
2.1 筛选产蛋白酶酵母菌结果及菌落特性 图1为10株产蛋白酶菌里的部分菌株菌落形态及水解圈。用十字交叉法测定水解圈直径及菌落直径,产酶能力强:BCY-8、BCY-20;产酶能力较强:BYL-15、BYL-16、BCY-6;产酶能力较弱:BYL-1、BYL-24、BCY-16、BCY-21、BCY-29。
2.2 生长温度测定结果 图2表明,10株产蛋白酶菌株中BYL-1、BCY-20、BCY-21、BLY-15、BYL-24的最适生长温度范围均在24 ℃左右;BCY-6、BCY-8、BYL-16最适生长温度为16 ℃左右;BCY-16、BCY-29的最适生长温度为28 ℃左右。

图1 产蛋白酶的酵母菌株菌落形态及水解圈
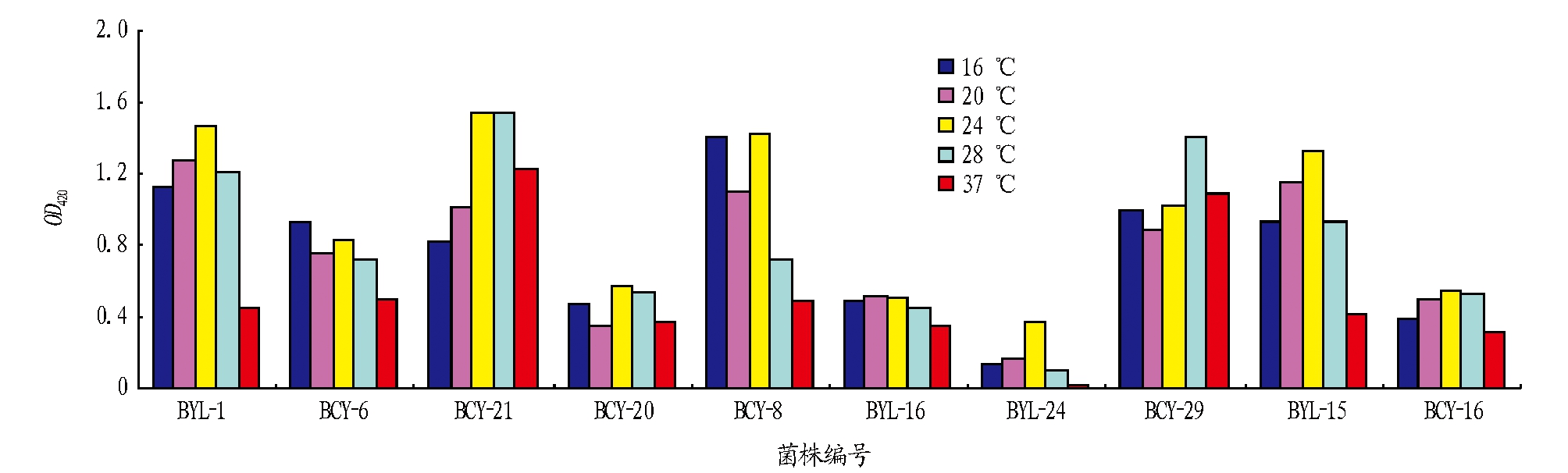
图2 不同酵母菌的最适生长温度
2.3 基于26S r RNA基因序列的酵母菌株系统发育分析 由图3可知,BYL-15与Uncultured basidiomycota相似性为97%,BCY-16与Rhodotorula laryngis相似性为98%。根据Kurtzman酵母种类的划分依据,相似性低于99%的,不能划为同一个种。BYL-16与Mazocraeoides gonialosae相似性为99%。BYL-1属于Cryptococcus,BYL-24属于Uncultured fungus,BCY-8属于Cryptococcus;BCY-6、BCY-16、BCY-20、BCY-21、BCY-29与Rhodotorula、Rhodotorula laryngis、Antarctic yeast在同一分支中。
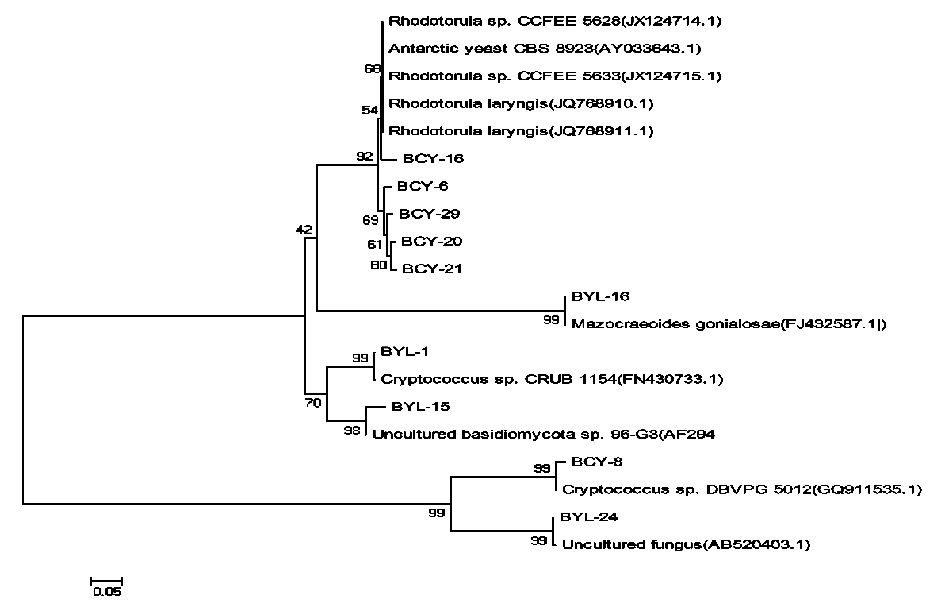
图3 基于26S rDNA 序列构建的系统发育树
3 讨论
根据文献报道,低温环境中分离的细菌大多数属于耐冷细菌,最适生长温度在20~25 ℃,只有部分菌株为专性嗜冷菌,最适生长温度在10~15 ℃。综上,BCY-6、BCY-8和BCY-20分别属于产酶能力强的专性嗜冷菌和耐冷菌;BYL-15和BYL-16分别是产酶能力较强的专性嗜冷菌和耐冷菌。除BCY-16和BCY-29,其他均属于产酶能力较弱的耐冷菌株。从系统发育来看,天山一号冰川底部沉积层中产蛋白酶的酵母菌主要隶属于Acidobacteria门中Rhodotorula属;而有文献报道,目前所有冷冻低温环境中隶属于 Acidobacteria门的可培养细菌几乎为零[1]。BCY-6和BCY-8菌落形态表型特征相同,均属产酶能力强的专性嗜冷菌,但明显BCY-6和BCY-8分别隶属于Rhodotorula和Cryptococcus属。说明依据菌落的差异标准不能准确反映冰川等冰冻圈环境中群落多样性,需要采用更精确的分子手段确定。
参考文献:
[1] 倪永清,顾艳玲,史学伟,等.天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育[J].微生物学报,2013,53(2):164-172.
[2] 李全海,张礼.蛋白酶在羊毛纤维改性方面的应用[J].河北纺织,2006,25(2):57-64.
[3] 胡学智,王俊.蛋白酶生产和应用的进展[J].工业微生物,2008,38(4):49-61.
[4] FELLER G,LONHIENNE T,DEROANNE C,et al.Purification,characterization and nucleotide sequence of the thermolabile α-protease from the Antarctic psychrotroph Alteromonas haloplanctis A23[J].J Biol Chem,1992,267:5217-5221.
[5] 张锐,曾润.极端微生物产碱性蛋白酶菌株的筛选及发酵条件的研究[J].微生物学通报,2001,28(4): 5-9.
[6] 曾胤新,蔡明红,陈波,等.一株北极海洋细菌及其蛋白酶的生理生化特征研究[J].极地研究,2000,12(4): 263-268.
[7] ZENG R,ZHANG R,ZHAO J,et al.Cold-active serineal kaline protease from the psychrophilic bacterium Pseudomonas strain DY-A: enzyme purification andcharacterization[J].Extremophiles,2003,7(4):335-337.
[8] ZHOU M Y,CHEN X L,ZHAO H L,et al.Diversityof both the cultivable protease-producing bacteria and their extracellular proteases in the sediments of the South China Sea[J].Microbial Ecology,2005,58(3):582-590.
[9] THOMPSON J D,GIBSON T J,PLEWNIAK F,et al.The CLUSTAL X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools[J].Nucleic Acids Res,1997,25:4876-4882.
[10] SAITOU N,NEI M.The neighbor-joining method: A new method for reconstructing phylogenetic trees[J].Mol Biol Evol,1987,4:406-425.
[11] TAMURA K,DUDLEY J,NEI M,et al.MEGA 4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J].Mol Biol Evol,2007,24:1596-1599.
Screening and Phylogenetic Analysis of Yeast Producing Protease from Permafrost of the Glacier No.1 in the Tianshan Mountains
Abstract:[Objective] This research was to isolate cold-adapted protease-producing strains of yeasts from permafrost of the Glacier No.1 in the Tianshan Mountains, study their physiological and biochemical characteristics, conduct phylogeny analysis. [Method] YPD was used to select yeast producing protease, which were identified through the hydrolysis circle. Then, the optimum temperature of the strains and phylogenetic position determined by the 26S rDNA D1/D2 sequences was studied. [Result] 10 isolates were cold-adapted protease-producing strains. The average size of cells were 2.60 to 5.00 μm and the optimum growth temperature was 24 ℃. Phylogenetic analysis showed that the 10 strains of yeast belonged toCryptococcu, Rhodotorula, Antarctic yeast, Uncultured fungus and Mazocraeoides gonialosae. [Conclusion] The study can lay a foundation for research and development of low-temperature protease.
Key words:Tianshan glacier No.1; Yeast; Protease; Phylogeny
基金项目:国家自然科学基金项目(40961002,41140009,41271268)。
收稿日期:2014-11-19
中图分类号:S 188+.4
文献标识码:A
文章编号:0517-6611(2015)01-248-03
